
Somos seres protéicos: a
vida está intimamente ligada às proteínas.
Estas moléculas especiais realizam as mais
variadas funções no nosso organismo, desde o
transporte de nutrientes e metabólitos à catálise de
reações biológicas. Apesar da complexidade de suas
funções, as proteínas são relativamente simples:
repetições de 20 unidades básicas, os amino ácidos.
Nesta edição o Portal de Estudos em Química aproxima
você ao fantástico mundo das Proteínas.
|
As proteínas são macromoléculas complexas, compostas de
amino ácidos, e necessárias para os processos químicos que
ocorrem nos organismos vivos. São os constituintes
básicos da vida: tanto que seu nome deriva da palavra
grega "proteios", que significa "em primeiro lugar".
Nos animais, as proteínas correspondem a cerca de 80% do
peso dos músculos desidratados, cerca de 70% da pele e 90%
do sangue seco. Mesmo nos vegetais as proteínas estão
presentes.
|
Cozinhando
proteínas
|
A
Reação de Maillard
 Como
saber quando uma pizza está
pronta, o bolo está no ponto ou
o frango está assado? Basta,
talvez, olhar: aquele aspecto
corado, dourado, é um forte
indício de que a comida está
cozida. Sabe de onde vem esta
cor?! É da reação de Maillard. Como
saber quando uma pizza está
pronta, o bolo está no ponto ou
o frango está assado? Basta,
talvez, olhar: aquele aspecto
corado, dourado, é um forte
indício de que a comida está
cozida. Sabe de onde vem esta
cor?! É da reação de Maillard.
São várias as reações químicas
que deixam o alimento marrom, ou
escurecido. Pirólise, por
exemplo, é um dos mais comuns:
quando deixamos o pão por muito
tempo na torradeira, ele volta
preto, queimado; ocorre uma
desitratação termicamente
induzida do amido, resultando
carbono (carvão) e água. O
açúcar, a 200oC,
carameliza, através de uma
desitratação, uma condensação e
uma polimerização. Entretanto,
nem a pirólise ou caramelização
inclui o que acontece com o
constituinte alimentar mais
importante, as proteínas.
Em altas temperaturas, os amino
ácidos das proteínas interagem
com açúcares redutores,
produzindo as cores, aromas e
sabores característicos do
alimento cozido. Esta reação
entre proteínas e carbohidratos
foi primeiramente descrita em
1912, por Louis-Camille Maillard
- daí o nome da reação.
Durante o cozimento, a reação de
Maillard (que envolve uma série
de etapas) inicia com uma
condensação entre amino ácidos e
açúcares. Estes compostos,
incolores, se rearranjam e
desidratam para formar
intermediários amarelados que,
finalmente, são convertidos para
polímeros vermelhos e marrons.
Um dos efeitos positivos da
reação de Maillard é o aspecto
visual de bolos, pizzas e
lasanhas quando cozidas; um
negativo é o escurecimento do
leite, quando aquecido por muito
tempo (tal como no doce de
leite).
A cor deriva das melanoidinas
formadas pela reação de Maillard.
A reação de Maillard também é
responsável pelo envelhecimento
de nosso organismo. Muitos
químicos vêm pesquisando drogas
que interrompam as reações de
Maillard numa tentativa de
minimizar os efeitos do
envelhecimento em nosso corpo.
Saiba mais:
>Usando
a lactose para dourar
>Douramento
enzimático
>Reação
de Maillard
>Envelhecimento
e a Reação de Maillard
|
|
A importância das proteínas, entretanto, está
relacionada com suas funções no organismo, e não com
sua quantidade. Todas as enzimas conhecidas, por
exemplo, são proteínas; muitas vezes, as enzimas
existem em porções muito pequenas. Mesmo assim,
estas substâncias catalisam todas as reações
metabólicas e capacitam aos organismos a construção
de outras moléculas - proteínas, ácidos nucléicos,
carbohidratos e lipídios - que são necessárias para
a vida.
As proteínas também são chamadas de
polipeptídeos,
porque os amino ácidos que as compõe são unidos por
ligações peptídicas (uma ligação peptídica é a união
do grupo amino (-NH2) de
um amino ácido com o grupo carboxila (-COOH) de
outro amino ácido, através da formação de uma amida.
 A
ligação C-N, em um peptídeo, é especial: é 10% mais
"curta" do que uma ligação C-N normal, e o ângulo de
ligação também é diferente do esperado para um
carbono sp2. Isto porque
a ligação peptídica, na verdade, apresenta uma
estrutura de ressonância, tendo um forte caráter
de dupla ligação - explicando, também, a rigidez
desta ligação e sua planaridade. Através destas
ligações, os amino ácidos formam cadeias longas; a
maioria das proteínas tem mais de 200 amino ácidos.
Todos os amino ácidos tem, em comum, um carbono
(chamado de carbono alfa) ligado a um grupo amino e
a um grupo carboxila. Este carbono alfa é um centro
estereogênico e, com excessão da glicina (porque não
é assimétrica), todos os amino ácidos, em todos os
organismos vivos terrestres, só aparecem sob a forma
L (veja
artigo "Drogas Quirais"). A
ligação C-N, em um peptídeo, é especial: é 10% mais
"curta" do que uma ligação C-N normal, e o ângulo de
ligação também é diferente do esperado para um
carbono sp2. Isto porque
a ligação peptídica, na verdade, apresenta uma
estrutura de ressonância, tendo um forte caráter
de dupla ligação - explicando, também, a rigidez
desta ligação e sua planaridade. Através destas
ligações, os amino ácidos formam cadeias longas; a
maioria das proteínas tem mais de 200 amino ácidos.
Todos os amino ácidos tem, em comum, um carbono
(chamado de carbono alfa) ligado a um grupo amino e
a um grupo carboxila. Este carbono alfa é um centro
estereogênico e, com excessão da glicina (porque não
é assimétrica), todos os amino ácidos, em todos os
organismos vivos terrestres, só aparecem sob a forma
L (veja
artigo "Drogas Quirais"). |
Embora sejam quase inúmeras, todas as proteínas são
formadas exclusivamente por apenas 20 amino ácidos, que
se repetem numa sequência característica para cada proteína.
Esta sequência, conhecida como
estrutura primária,
é que, de fato, determina a forma e a função da proteína. A
estrutura primária é somente a sequência dos amino ácidos,
sem se preocupar com a orientação espacial da molécula. As
interações intermoleculares (veja
artigo: "Forças
Intermoleculares") entre os amino ácidos das
proteínas fazem com que a cadeia protéica assuma uma
estrutura secundária e, algumas vezes, uma estrutura
terciária.
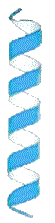  A
estrutura secundária
é uma função dos ângulos formados pelas ligações peptídicas
que ligam os amino ácidos. Segundo a IUPAC, "The
secondary structure of a segment of polypeptide chain is the
local spatial arrangement of its main-chain atoms without
regard to the conformation of its side chains or to its
relationship with other segments". A conformação
espacial é mantida graças as interações intermoleculares
(ligação hidrogênio) entre os hidrogênios dos grupos amino e
os átomos de oxigênio dos outros amino ácidos. A
estrutura secundária
é uma função dos ângulos formados pelas ligações peptídicas
que ligam os amino ácidos. Segundo a IUPAC, "The
secondary structure of a segment of polypeptide chain is the
local spatial arrangement of its main-chain atoms without
regard to the conformation of its side chains or to its
relationship with other segments". A conformação
espacial é mantida graças as interações intermoleculares
(ligação hidrogênio) entre os hidrogênios dos grupos amino e
os átomos de oxigênio dos outros amino ácidos.
Em geral, estas ligações forçam a proteína a assumir uma
forma helicoidal, como uma corda enrolada em torno de um
tubo imaginário. Esta forma, a mais comum, é chamado de alfa hélice.
Outras duas formas na estrutura secundária são as
beta-sheets e turns. Nas beta-sheets, um
segmento da cadeia interage com outro, paralelamente.
Esta forma, a mais comum, é chamado de alfa hélice.
Outras duas formas na estrutura secundária são as
beta-sheets e turns. Nas beta-sheets, um
segmento da cadeia interage com outro, paralelamente.
"Turns" são o terceiro tipo das estruturas
secundárias clássicas, e são responsáveis pela reversão da
direção da cadeia
 polipeptídica.
Eles são localizados na superfície polar da proteína, e
contém resíduos com carga. Os sítios de reconhecimento dos
anticorpos, da fosforilação, glicosilação e da hidroxilação
são encontrados, frequentemente, nos ou próximos dos turns. polipeptídica.
Eles são localizados na superfície polar da proteína, e
contém resíduos com carga. Os sítios de reconhecimento dos
anticorpos, da fosforilação, glicosilação e da hidroxilação
são encontrados, frequentemente, nos ou próximos dos turns.
 A
estrutura terciária
relaciona-se com os loopings e dobraduras da cadeia
protéica sobre ela mesma. É a conformação espacial da
proteína, como um todo, e não de determinados segmentos
particulares da cadeia protéica. A forma das proteínas
está relacionada com sua estrutura terciária. Existem, por
exemplo, proteínas globulares (que tem forma
esférica). O que determina a estrutura terciária são as
cadeias laterais dos amino ácidos; algumas cadeias são tão
longas e hidrofóbicas que perturbam a estrutura secundária
helicoidal, provocando a dobra ou looping da proteína.
Muitas vezes, as partes hidrofóbicas da proteína agrupam-se
no interior da proteína dobrada, longe da água e dos íons do
ambiente onde a proteína se encontra, deixando as partes
hidrofílicas expostas na superfície da estrutura da
proteína. Regiões como "sítio ativos", "sítios regulatórios"
e módulos são propriedades da estrutura terciária. A
estrutura terciária
relaciona-se com os loopings e dobraduras da cadeia
protéica sobre ela mesma. É a conformação espacial da
proteína, como um todo, e não de determinados segmentos
particulares da cadeia protéica. A forma das proteínas
está relacionada com sua estrutura terciária. Existem, por
exemplo, proteínas globulares (que tem forma
esférica). O que determina a estrutura terciária são as
cadeias laterais dos amino ácidos; algumas cadeias são tão
longas e hidrofóbicas que perturbam a estrutura secundária
helicoidal, provocando a dobra ou looping da proteína.
Muitas vezes, as partes hidrofóbicas da proteína agrupam-se
no interior da proteína dobrada, longe da água e dos íons do
ambiente onde a proteína se encontra, deixando as partes
hidrofílicas expostas na superfície da estrutura da
proteína. Regiões como "sítio ativos", "sítios regulatórios"
e módulos são propriedades da estrutura terciária.
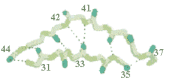
 Existe,
finalmente, a estrutura
quaternária: certas proteínas, tal como a
hemoglobina, são compostas por mais de uma unidade
polipeptídica (cadeia protéica). A conformação espacial
destas cadeias, juntas, é que determina a estrutura
quaternária. Esta estrutura é mantida pelas mesmas forças
que determinam as estruturas secundárias e terciárias. A
figura ao lado mostra uma imumoglobulina que é, na verdade,
um tetrâmero, isto é, constituída por 4 cadeias protéicas (polipeptídeos). Existe,
finalmente, a estrutura
quaternária: certas proteínas, tal como a
hemoglobina, são compostas por mais de uma unidade
polipeptídica (cadeia protéica). A conformação espacial
destas cadeias, juntas, é que determina a estrutura
quaternária. Esta estrutura é mantida pelas mesmas forças
que determinam as estruturas secundárias e terciárias. A
figura ao lado mostra uma imumoglobulina que é, na verdade,
um tetrâmero, isto é, constituída por 4 cadeias protéicas (polipeptídeos).
 As
proteínas podem ser simples (constituidas somente por
amino ácidos) ou conjugadas (que contém grupos
prostéticos, isto é, grupos não amino ácidos, tais como
carbohidratos, íons, pigmentos, etc., como na figura ao
lado). A hemoglobina é um exemplo de proteína
conjugada: contém 4 grupos prostéticos, cada um consistindo
de um íon de ferro e a porfirina. São justamente estes
grupos que habilitam a hemoglobina a carregar o oxigênio
através da corrente sanguínea. As liproproteínas, tal
como LDL e HDL, são também exemplos de proteínas conjugadas
- neste caso, com lipídeos. As
proteínas podem ser simples (constituidas somente por
amino ácidos) ou conjugadas (que contém grupos
prostéticos, isto é, grupos não amino ácidos, tais como
carbohidratos, íons, pigmentos, etc., como na figura ao
lado). A hemoglobina é um exemplo de proteína
conjugada: contém 4 grupos prostéticos, cada um consistindo
de um íon de ferro e a porfirina. São justamente estes
grupos que habilitam a hemoglobina a carregar o oxigênio
através da corrente sanguínea. As liproproteínas, tal
como LDL e HDL, são também exemplos de proteínas conjugadas
- neste caso, com lipídeos.
Uma outra forma de classificar as proteínas é baseado na
sua função. Sobre este prisma, elas podem ser divididas
em dois grupos: proteínas estruturais e proteínas
biologicamente ativas. Algumas proteínas, entretanto, podem
pertencer aos dois grupos. A maioria das proteínas
estruturais são fibrosas - compostas por cadeias
alongadas. Dois bons exemplos, nos animais, são o colágeno
(ossos, tendões, pele e ligamentos) e a queratina (unhas,
cabelos, penas e bicos).
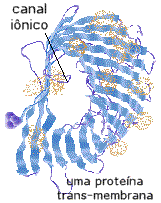
A grande maioria das proteínas biologicamente ativas são
globulares, e sua atividade funcional é intrínsica a sua
organização espacial. Exemplos são as
enzimas, hormônios
protéicos (que atuam como mensageiros químicos), proteínas
de transporte (como as lipo-proteínas, que podem carregar o
colesterol) e imunoglobulinas (ou anticorpos), que protegem
o corpo de microorganimos invasores. Muitas proteínas
biologicamente ativas ficam na região da membrana celular,
e atuam de diversas maneiras. A figura ao lado mostra uma
porina, uma proteína trans-membrana, que atua
como um canal iônico em bactérias. Existe um "buraco" na
estrutura protéica, de cerca de 11 angstrons de diâmetro,
onde os íons passam, seletivamente.
 As
enzimas são uma
classe muito importante de proteínas biologicamente ativas.
Elas são responsáveis pela catálise de diversas reações em
nosso organismo. Reações que, sem o auxílio das enzimas,
jamais aconteceriam ou, ainda, gerariam indesejados produtos
colaterais. Em uma proteína enzimática, existe um certo
domínio chamado de "sítio ativo", que liga-se ao substrato -
a molécula reagente - e diminui a energia do estado de
transição que leva ao produto desejado. A ligação
entre o sítio ativo e o substrato é extremamente específica:
a molécula precisa ter certas características eletrônicas e
espaciais que permitam o seu "encaixe" com a proteína. Por
isso esta relação tem sido chamada de lock'n'key, ou
seja, chave-fechadura. As
enzimas são uma
classe muito importante de proteínas biologicamente ativas.
Elas são responsáveis pela catálise de diversas reações em
nosso organismo. Reações que, sem o auxílio das enzimas,
jamais aconteceriam ou, ainda, gerariam indesejados produtos
colaterais. Em uma proteína enzimática, existe um certo
domínio chamado de "sítio ativo", que liga-se ao substrato -
a molécula reagente - e diminui a energia do estado de
transição que leva ao produto desejado. A ligação
entre o sítio ativo e o substrato é extremamente específica:
a molécula precisa ter certas características eletrônicas e
espaciais que permitam o seu "encaixe" com a proteína. Por
isso esta relação tem sido chamada de lock'n'key, ou
seja, chave-fechadura.
No exemplo da figura ao lado, uma determinada região da
proteína - o módulo SH2 - liga-se à tirosina fosfatada, que
se adapta ao sítio ativo da enzima tal como uma chave faz a
sua fechadura.
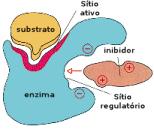 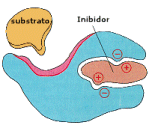
A atividade de uma enzima pode ser bloqueada pela
ação de outra molécula, um inibidor. Quando um inibidor
interage com uma determinada região da enzima, chamado de
sítio regulatório, provoca uma alteração na sua conformação
e uma desativação do sítio catalítico. A atividade
enzimática, portanto, pode ser controlada, pelo organismo,
através da liberação ou captação de inibidores.
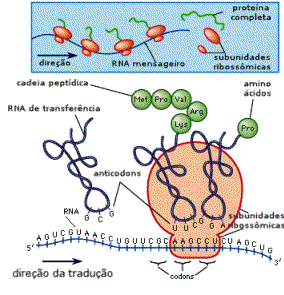
A sequência dos amino ácidos em todas as proteínas - fator
que é responsável por sua estrutura e função - é determinado
geneticamente a partir da sequência dos nucleotídeos no
DNA celular. Quando uma proteína em particular é
necessária, o código do DNA para esta proteína é transcrito
em uma sequência complementar de nucleotídeos ao longo de um
segmento de RNA - chamado de RNA mensageiro. Este segmento
de RNA serve como uma forma para a síntese da proteína
subsequente: cada grupo de 3 nuclueotídeos especifica um
determinado amino ácido; estes amino ácidos são ligados na
sequência codificada pelo RNA. No final do processo,
obtém-se a proteína completa, cuja sequência de amino ácidos
foi ditada pelo RNA mensageiro. Desta maneira, o organismo é
capaz de sintetizar as várias proteínas com as funções mais
diversas de que precisa.
|

Como é feita a comunicação intercelular? Como agem os mensageiros
químicos?
O Portal de Estudos em Química apresenta uma introdução sobre a
Comunicação Intercelular.
 A
transmissão do sinal intracelular usualmente inicia quando
uma determinada molécula (como, por exemplo, um hormônio),
responsável por carregar a informação da célula transmissora para
outra liga-se temporariamente com um receptor específico na célula
receptora do sinal. A
transmissão do sinal intracelular usualmente inicia quando
uma determinada molécula (como, por exemplo, um hormônio),
responsável por carregar a informação da célula transmissora para
outra liga-se temporariamente com um receptor específico na célula
receptora do sinal.
Esta
ligação é bastante específica: receptor e transmissor podem ser
comparados a uma fechadura e sua chave. Somente uma molécula com uma
determinada estrutura e distribuição eletrônica característica é que
pode se ligar ao receptor.
O receptor típico é uma proteína; na verdade, uma
determinada região da proteína. Estas proteínas ficam adsorvidas na
membrana celular e, usualmente, possuem 3 regiões: uma externa, que
é o receptor; outra na interface com o citoplasma e uma espécie de
"cauda", que se extende pelo interior da célula. Quando uma molécula
liga-se ao receptor, ocorre uma mudança na conformação da proteína
que pode provocar uma alteração na membrana citoplasmática ou,
ainda, facilitar a interação da cauda da proteína com uma ou mais
moléculas no citoplasma. Isto inicia um mecanismo em cascata, para a
posterior retransmissão do sinal intracelular.
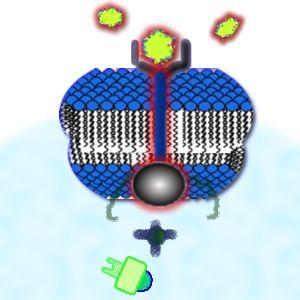
A
proteína trans-membrana é ativada pela presença de uma molécula que
se liga ao receptor, tal como ocorre com as tirosina-kinases.
Estas
proteínas, quando ativadas, atuam como enzimas capazes de adicionar
grupos fosfato a determinados grupos amino-ácidos em uma cadeia
protéica. Tony R. Hunter do Salk Institute for Biological Studies na
Califórnia demonstrou que, na verdade, esta adição ocorre somente no
amino ácido tirosina.
Ao se ligar no sítio receptor, o hormônio provoca uma alteração
conformacional da proteína trans-membrana, que inicia o processo de
fosfatização da tirosina.
A
proteína trans-membrana cataliza a fosfatização da tirosina de
certas proteínas.
Estas proteínas fosforiladas funcionam como adaptadores para a
próxima etapa: a ligação dos módulos SH2 de outras proteínas.
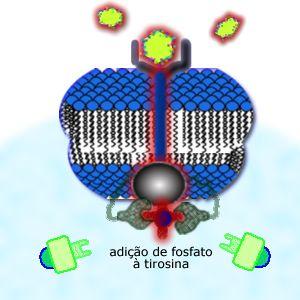
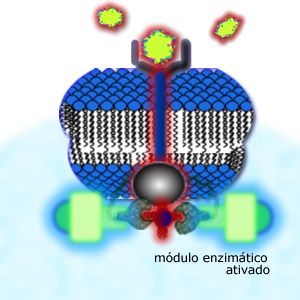
Após
esta etapa, estas proteínas com grupos tirosina fosforilados, são
capazes de interagir com determinadas regiões de outras proteínas,
conhecido como Módulos SH2.
Um módulo é uma sequência de cerca de 100 amino ácidos em uma cadeia
protéica, com uma determinada conformação espacial.
O módulo
SH2 é uma espécie de "chave de ignição" da proteína:
encontra-se, em geral, próximo ao seu sítio enzimático, bloqueando a
ação da proteína. Quando liga-se com as proteínas que contém os
grupos tirosina fosforilados, o módulo SH2 libera o sítio enzimático
e a proteína torna-se, então, uma enzima ativa, capaz de catalizar
determinadas reações no citoplasma.
Neste exemplo, a transmissão do sinal envolveu 3 proteínas: a
receptora, uma adaptadora (aquela que teve os grupos tirosina
modificados) e, por fim, a enzima "dormente". |