PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
Computadores descobrem novo tipo de ligação química
Os cientistas planejam escrever um novo livro-texto de Química,
dando uma nova explicação sobre como as ligações químicas
"realmente" ocorrem. [Imagem: NCSA]
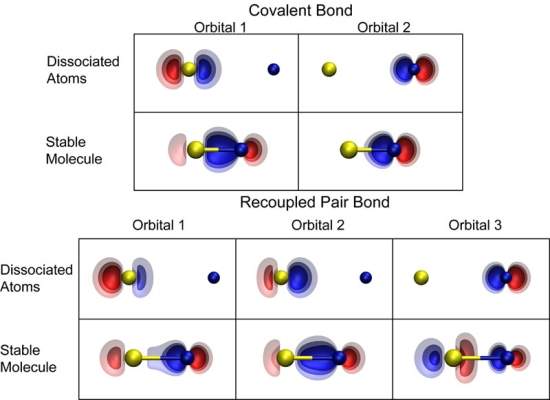
Pares reacoplados Uma simulação inteiramente feita em computador ajudou químicos a identificarem um tipo de ligação química desconhecida até agora. "Esse fenômeno tem implicações para toda a química," afirmou Thom Dunning, da Universidade de Illinois, nos Estados Unidos. Dunning e seus colegas batizaram o novo tipo de ligações química de "ligação de pares reacoplados" (recoupled pair bonding). "Os químicos sabem há muito tempo que a química dos elementos do grupo principal, do nitrogênio até o flúor, é diferente da química dos elementos nas linhas abaixo na tabela periódica," explica Dunning. "A questão é: o que torna o fósforo diferente do nitrogênio, ou o enxofre diferente do oxigênio? Parece que este novo tipo de ligação é uma das principais causas dessas anomalias," afirma ele. Hipervalência Uma das principais dentre essas anomalias é a chamada hipervalência, uma grande classe de moléculas que forma um número de ligações maior do que o esperado. A Regra dos Octetos estabelece que os átomos querem ter oito elétrons em sua camada de valência. Quando se sabe quantos elétrons um átomo tem em sua camada de valência é possível saber como ele irá ganhar, perder ou compartilhar elétrons para formar octetos - o que revela o número de ligações que o átomo pode formar. Mas as moléculas hipervalentes formam mais ligações do que seria de se esperar, como se tivessem mais do que oito elétrons em suas camadas de valência. O que os cientistas descobriram agora é que essas moléculas podem formar um outro tipo de ligação química. Novo tipo de ligação química Imagine dois átomos, um com 2 e outro com 1 elétron na camada externa. Normalmente, elétrons pareados não participam de uma ligação - é necessário separá-los para que o átomo forme uma ligação. Alguns átomos, como o flúor, conseguem forçar essa separação. Um elétron do par original é "reacoplado" pelo flúor, formando uma ligação de par reacoplado com o elétron no orbital ocupado por um único elétron. O outro elétron, que estava anteriormente pareado, está agora disponível para formar uma outra ligação. Desta forma, tem-se duas ligações onde se acreditava poder haver apenas uma. "O mais interessante sobre nossa teoria é que ela é uma teoria preditiva," diz David Woon, coautor do estudo. "Quando nós estudamos compostos de fósforo e cloro, nós intuímos como eles se comportariam baseados no que havíamos aprendido com as ligações de pares reacoplados nos compostos de enxofre." E a "intuição" a partir da nova teoria funcionou, algo que não é explicado pela Regra dos Octetos. Os cientistas agora planejam escrever um novo livro-texto de Química, dando uma nova explicação sobre como as ligações químicas "realmente" ocorrem.
Bibliografia:
Bonding and Isomerism in SFn-1Cl (n = 1-6): A Quantum Chemical Study Jeff Leiding, David E. Woon, Thom H. Dunning Jr. Journal of Physical Chemistry A Vol.: 115 (3), pp 329-341 DOI: 10.1021/jp107916c
Este site foi atualizado em 04/03/19 |