Queratina é uma proteína secundária, forma tridimensional de α-hélice (α-queratina), constituídas de cerca de 15 aminoácidos, principalmente de um aminoácido sulfurado denominado cisteína. Essas estruturas ocorrem porque os aminoácidos da queratina interagem entre si através de pontes de hidrogênio e ligações covalentes bissulfito (-S-S-) denominadas ligações cisteídicas.
![]() CURIOSIDADES QUÍMICAS
CURIOSIDADES QUÍMICAS![]()
ÍNDICE
|
Porque ás vezes a chama do fogão fica vermelha deixando o fundo da panela preta? | |
QUAL COMPOSTO COM O CHEIRO MAIS DESAGRADÁVEL?
Muitos compostos de enxofre com baixo peso molecular produzem reações adversas nas pessoas, mesmo que estas nunca tinham entrado em contato com estes compostos antes.
São exemplos disso:
-Emissões do gambá (n-butiltiol): H3C - CH2 - CH2 - CH2 - SH
-O ácido butanóico que faz lembrar o cheiro de vômito:
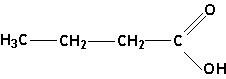
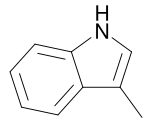
- o 3-metilindol (escatol), um composto heterocíclico presente nos excrementos:
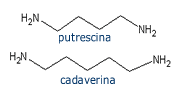
-1,4-butanodiamina (Putrescina) e 1,5-pentanodiamina (cadaverina) são produtos de decomposição de alguns amino ácidos encontrados em animais, responsáveis pelo odor característico do cadáver em estado de putrefação. São tóxicas e possuem um odor delicioso para os urubus.
-Mau hálito (halitose) pode ser causado por:

1- Compostos sulfurados voláteis. Existem em grande quantidade nos casos de doença periodontal e saburra lingual (ex: sulfidreto H2S, metilmercaptana CH3SH e dimetilsulfeto CH3-S-CH3.
2- Compostos orgânicos voláteis originados da putrefação da matéria orgânica (ex: indol, escatol, putrescina, cadaverina, metano CH4).
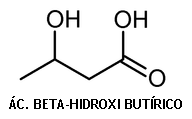
3- Compostos orgânicos voláteis de origem metabólica ou sistêmica oriundos da circulação sanguínea (originados do próprio metabolismo), com proveniência de alimentos ingeridos ou medicamentos utilizados (ex: ácido beta-hidroxidobutírico - produzido pelo fígado durante a cetose).
Qual o composto químico com a maior quantidade de elementos químicos?
Trata-se de uma molécula que possui 10 elementos químicos na sua composição e designa-se de :
tungsten-dichloro(diiodocadmium)bis[m -[diphenylphosphino-1-propanaminato-N:P]]dinitrosylbis[tris(3,5-dimethyl 1-H-pyrazolato-N1)hydroborato(1-)N2,N2,N2]di-
A fórmula estrutural deste composto é a seguinte:
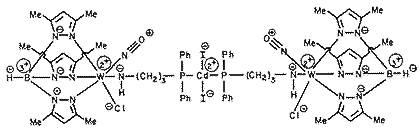
Uma
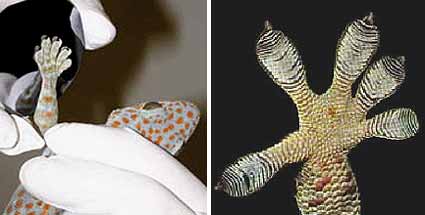
dúvida cruel tem atormentado muitos cientistas: como é que uma lagartixa
consegue caminhar pelas paredes, e ate mesmo no teto?
Alguns sugeriram que as suas patas possuíam microventosas. Entretanto, todas
as tentativas de se provar a existência de tais ventosas falharam: as
lagartixas possuem tal comportamento mesmo sob vácuo ou sobre uma superfície
muito lisa e molhada.
Em 1960, o alemão Uwe Hiller sugeriu que um tipo de força atrativa, entre as
moléculas da parede e as moléculas da pata da lagartixa, fosse a responsável
por tal fato. Hiller sugeriu que estas forças fossem as forças
intermoleculares de Van Der Waals.
Mas, tudo bem que elas mantenham moléculas unidas, mas... uma lagartixa?
Poucos deram crédito à sugestão de Hiller. Até que, em um exemplar recente da revista Nature, Autumn escreveu o artigo "Full, Adhesive force of a single gecko foot-hair" (Autumn, K. et al., Nature 405, 681-685 (2000)), trazendo evidências de que, de fato, são forças intermoleculares (interações eletromagnéticas fracas) as responsáveis pela adesão da pata da lagartixa à parede. Mais precisamente: os dedos das lagartixas terminam em milhões de pequenos filamentos, cada um com comprimento de cerca de 100 milionésimos de metro. Essas pequenas estruturas, por sua vez, estão subdividas em mil partes ainda menores, invisíveis a olho nu. Quando os répteis pressionam suas patas contra uma superfície, os filamentos se espalham e cobrem uma área relativamente grande. Como os filamentos aumentam a superfície de contato, um número maior de Forças de Van Der Waals atua entre a pata do animal e a parede, garantindo uma adesão segura.
A descoberta pode ajudar os engenheiros a desenvolverem novos tipos de adesivos.
Porque ás vezes a chama do fogão fica vermelha deixando o fundo da panela preta?

O propano (C3H8) e o butano (C4H10) são os principais componentes do gás que habitualmente se consome, conhecido como GLP (gás liquefeito de petróleo), no entanto existe também uma pequena quantidade de pentano (C5H12), menos volátil. Quando o gás está a acabar o pentano é arrastado para queimar.
Assim sendo agora é fácil explicar o que acontece: o pentano tem 5 carbonos, e exige mais oxigênio para uma "queima limpa". Como o nosso ar só tem 21% de oxigênio em volume, a queima é incompleta e a chama fica fuliginosa, queimando portanto o fundo da panela. Os gases propano e butano são inodoros, porém é acrescentado uma substância orgânica (mercaptanas) para que produza odor para melhor percepção em caso de vazamento.
A
fórmula de ácido láctico, C3H6O3 é a de um
carbo idrato,
classe de compostos que inclui os açúcares.
idrato,
classe de compostos que inclui os açúcares.
O leite fresco pode ser facilmente contaminado por bactérias que metabolizam o seu açúcar, a lactose, consumindo-a para obter energia, e excretam o ácido láctico. O ácido provoca a coalescência da gordura do leite, em pequenas gotículas, e o leite talha.
A fabricação de iogurte e de queijos é versão controlada deste processo. Quando fazemos exercícios, o nosso corpo usa a glicose (do glicogénio) como fonte de energia. O metabolismo da glicose produz ácido pirúvico, CH3COCO2H que é queimado aerobicamente (na presença de O2) para dar dióxido de carbono e água. Quando se precisa de intenso pulso de energia, como numa corrida de curta distância, os músculos podem não ter oxigênio suficiente, e o ácido pirúvico é degradado anaerobicamente (sem oxigênio) para dar energia e ácido láctico. É o acumular de ácido láctico nos músculos que dá a sensação de dores e cansaço muscular.
O ácido láctico também é produzido no nosso organismo como parte do metabolismo normal e é removido pela ação do fígado. Quando se ingere muita bebida alcoólica, é o fígado que metaboliza o álcool. Se a bebida for muita, o metabolismo do ácido láctico pode ficar prejudicado e o ácido se acumula no organismo, dando a sensação de fadiga e mal-estar.
QUÍMICA DA CÁRIE
Desde sempre existiram problemas que afetaram em muito a humanidade e um deles é sem duvida a cárie dentária. Embora as suas causas sejam bem conhecidas, ainda não existe nenhuma profilaxia completamente conhecida.
Os dentes são revestidos por uma camada exterior, o esmalte com uma espessura com cerca de 2mm. Esta é composta por um mineral, a hidroxiapatita, cuja formula é Ca5(PO4)3OH. Quando se dissolve (desmineralização), os íons ficam dispersos pela saliva:
Ca5(PO4)3OH (s) ↔ 5Ca2+ (aq) + 3PO43- (aq) + OH-(aq)
Sendo os fosfatos de metais alcalinos terrosos (como o cálcio) insolúveis, esta reação não é muito extensa. Já inversa, a mineralização, é a defesa natural do corpo contra a cárie. Nas crianças esta reação prevalece sobre a direta e nos adultos têm aproximadamente mesma velocidade.
Durante as refeições, as bactérias presentes na boca decompõem parte dos alimentos produzindo ácidos orgânicos como o acético. Esta produção é máxima com a digestão de doces. Como conseqüência existe uma diminuição do pH, levando ao desaparecimentos do OH-:
H+(aq) + OH-(aq) → H2O(l)
Com a diminuição do OH- na boca, o sistema vai evoluir no sentido de contrariar esta reação, ou seja vai aumentar a desmineralização.
Com o esmalte enfraquecido, começa a formação da cárie.
Logo a melhor forma de combater a cárie será, comer menos doces e lavar os dentes após as refeições pois a maioria das pastas de dentes contém composto com flúor, tais como: NaF. SnF2, que substitui de forma eficaz algum OH- , através de uma reação equivalente:
5Ca2+(aq) + 3PO43-(aq) + F-(aq) → Ca5(PO4)3F(s)

Sr Metano
Os gases estomacais têm várias origens, podem ser provenientes de ar engolido, de reações químicas no aparelho digestivo, produzido por bactérias ou oriundo da corrente sanguínea. A composição do peido é bastante variada, a reação entre o ácido produzido no estômago e os fluidos do intestino pode produzir dióxido de carbono (CO2), que também é um componente do ar (atmosférico) e/ou resultante da ação das bactérias. As bactérias também podem produzir hidrogênio (H2) e metano (CH4). As proporções da composição dos gases intestinais pode depender de vários fatores, tais como, o que comemos, quanto ar é engolido, que tipo de bactérias estão no aparelho digestivo e quanto tempo o gás permanece preso. Quanto mais o gás permanece preso, maior é a proporção de nitrogênio em sua composição, pois os outros gases podem ser absorvidos pela corrente sanguínea.
Todo o metano produzido é de origem
bacteriana e não tem origem das células humanas.
O fedor do peido tem origem na presença de gás sulfídrico (H2S),
metanotiol (H3C-SH), dimetil sulfeto (H3C-S-CH3)
e mercaptanas na mistura. Estes compostos contém enxofre em sua composição.
A proporção dos compostos fedorentos representa algo como 1% do total.
Compostos ricos em nitrogênio, tais como escatol (3-metil indol) e indol também contribuem para o mau cheiro.
Quanto mais a dieta for rica em alimentos ricos em enxofre, maiores os problemas. por exemplo couve-flor, repolho, ovos e carne. Também pode existir um fator genético que predispõem um indivíduo a ter mais problemas com gases.
Em um adulto a produção de gases intestinais
varia de 200 a 2000ml diários.
 A
quantidade de hidrogênio e metano na composição total pode tornar os gases
inflamáveis.
A
quantidade de hidrogênio e metano na composição total pode tornar os gases
inflamáveis.
Uma observação importante é que o metano, hidrogênio, gás carbônico e
nitrogênio
não
possuem odor.
COMO OCORRE O PROCESSO DE AMADURECIMENTO DAS FRUTAS

O etileno é o gás responsável pelo amadurecimento as frutas. Daí é usado para amadurecer de maneira forçada frutas verdes
Eteno (etileno)
O etileno funciona como um
hormônio, é produzido a partir das células e se faz presente em toda a
estrutura do fruto, desde a casca até seu interior. Conheça as 3 reações que
acontecem durante o processo de maturação de frutas:
1.
Oxidação de lipídios: Essa reação é
produzida pelo etileno e é responsável pelo rompimento nas fibras do fruto,
tornando-o macio;
2. Quebra das ligações
de amido: A doçura das frutas maduras
aparece neste momento: durante a quebra das ligações do amido presente em
sua composição;
3. Quebra das moléculas
de clorofila: O etileno
é responsável ainda por quebrar as moléculas de clorofila presente na casca
do fruto, que lhe confere a cor verde. Após esta reação, dependendo do
fruto, a coloração fica avermelhada ou amarelada.
DICA: Se quiser acelerar o amadurecimento do tomate e banana em sua própria
casa, basta colocá-los em um recipiente fechado. Estes frutos exalam etileno
quando estão maduros, abafando-os você evita que o etileno gasoso escape,
fique retido no recipiente e acelere o processo de maturação das frutas
verdes.
Em países com clima Tropical, como é o caso do Brasil, as frutas se
deterioram com muita facilidade, e por isso os comerciantes precisam usar
destes artifícios para obterem as espécies frutíferas com aspecto saudável,
atraentes e, sobretudo, saborosas.
O cabelo é constituído, basicamente, de uma proteína: a alfa-queratina. As queratinas (alfa e beta) são, também, constituintes de outras partes de animais, como unhas, a seda, bicos de aves, chifres, pêlos, cascos, espinhos (do porco-espinho), entre outros.
Em cada fio de cabelo, milhares de cadeias de alfa-queratina estão entrelaçadas em uma forma espiral, sob a forma de placas que se sobrepõem, resultando em um longo e fino "cordão" protéico. Estas proteínas interagem fortemente entre si, por várias maneiras, resultando na forma característica de cada cabelo: liso, enrolado, ondulado, etc.
 A
raiz de cada fio capilar está contida numa bolsa tubular da epiderme chamada
folículo capilar. Estima-se que existam cerca de 5 milhões de
folículos capilares no corpo humano. As únicas partes da pele que não têm
folículos são as palmas da mão e as solas dos pés. O folículo recebe
irrigação na epiderme e, algumas vezes, pode apresentar disfunções, levando
ou ao crescimento excessivo de cabelos (ou pelos) ou à queda de cabelos, um
problema enfrentado por boa parte da população.
A
raiz de cada fio capilar está contida numa bolsa tubular da epiderme chamada
folículo capilar. Estima-se que existam cerca de 5 milhões de
folículos capilares no corpo humano. As únicas partes da pele que não têm
folículos são as palmas da mão e as solas dos pés. O folículo recebe
irrigação na epiderme e, algumas vezes, pode apresentar disfunções, levando
ou ao crescimento excessivo de cabelos (ou pelos) ou à queda de cabelos, um
problema enfrentado por boa parte da população.
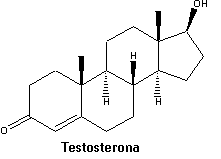
A queda de cabelos é mais freqüente nos homens, e estudos indicam que ela está associada à testosterona. Este hormônio é convertido, por uma enzima encontrada nos folículos, em dihidrotestosterona (DHT), que é capaz de se ligar a receptores nos folículos.
A cor do cabelo vem de pigmentos, como a melanina, que são agregados ao cabelo a partir do folículo capilar, o aparelho que é responsável pela produção do mesmo. Em geral, a cor do cabelo está relacionada à cor da pele: pessoas com pele escura tendem a ter cabelos escuros, e vice-versa. Isto porque a pigmentação do cabelo depende da quantidade de melanócitos presentes.
Números:
| um adulto tem cerca de 150 mil fios de cabelos na cabeça; | |
| o número total, incluindo todos os pêlos, chega a mais de 1 milhão; | |
| o cabelo cresce cerca de 2cm por mês; | |
| apenas 3 meses após a fecundação, os primeiros fios de cabelo já nascem no feto. |
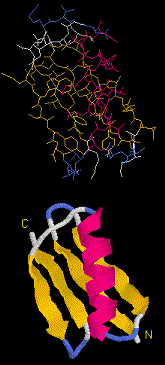 Uma
proteína é uma seqüência de aminoácidos, um polipeptídeo. A
queratina é formada por cerca de 15 aminoácidos diferentes, que se repetem e
interagem entre si. Na conformação alfa, cada cadeia polipeptídica
enrola-se sobre si mesma, no formato de uma hélice (como uma escada de
caracol). Na conformação beta, as cadeias ficam semi-estiradas,
dispostas paralelamente. A figura ao lado ilustra a proteína G, que
apresenta as duas conformações: alfa, em lilás, e beta, em amarelo.
Uma
proteína é uma seqüência de aminoácidos, um polipeptídeo. A
queratina é formada por cerca de 15 aminoácidos diferentes, que se repetem e
interagem entre si. Na conformação alfa, cada cadeia polipeptídica
enrola-se sobre si mesma, no formato de uma hélice (como uma escada de
caracol). Na conformação beta, as cadeias ficam semi-estiradas,
dispostas paralelamente. A figura ao lado ilustra a proteína G, que
apresenta as duas conformações: alfa, em lilás, e beta, em amarelo.
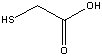
As ligações intramoleculares entre os aminoácidos da mesma cadeia é que sustentam a configuração da cadeia. Entre os tipos de interação, destacam-se as pontes de hidrogênio e as pontes cistínicas, que são as pontes formadas entre os grupos -SH do aminoácido cistina, presente na queratina.
Como se faz o cabelo "Permanente" ?
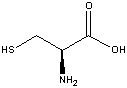 Um
dos aminoácidos presentes na queratina é a cisteína, responsável
pelas ligações cisteínicas. A cisteína, RSH, pode interagir com outra
cisteína da mesma cadeia polipetídica, e formar uma ligação convalente, RSSR.
Estas ligações são responsáveis pelas "ondas" que aparecem em nossos
cabelos. A possibilidade da interconversão entre as formas oxidadas (RSSR) e
reduzidas (RSH) da cisteína é que permite ao cabelereiro "moldar" o seu
cabelo, ou seja, alisar um cabelo crespo, ou fazer "cachos" e "ondas" em um
cabelo liso.
Um
dos aminoácidos presentes na queratina é a cisteína, responsável
pelas ligações cisteínicas. A cisteína, RSH, pode interagir com outra
cisteína da mesma cadeia polipetídica, e formar uma ligação convalente, RSSR.
Estas ligações são responsáveis pelas "ondas" que aparecem em nossos
cabelos. A possibilidade da interconversão entre as formas oxidadas (RSSR) e
reduzidas (RSH) da cisteína é que permite ao cabelereiro "moldar" o seu
cabelo, ou seja, alisar um cabelo crespo, ou fazer "cachos" e "ondas" em um
cabelo liso.
 A
primeira etapa consiste na redução de todos os grupos RSSR. Isto se faz,
geralmente, com a aplicação do ácido tioglicólico (também conhecido
como ácido 2-mercaptoacético) em uma solução de amônia (pH 9). Esta solução
reduz os grupos RSSR para RSH (os cabelereiros chamam esta solução de
"relaxante").
A
primeira etapa consiste na redução de todos os grupos RSSR. Isto se faz,
geralmente, com a aplicação do ácido tioglicólico (também conhecido
como ácido 2-mercaptoacético) em uma solução de amônia (pH 9). Esta solução
reduz os grupos RSSR para RSH (os cabelereiros chamam esta solução de
"relaxante").
A segunda etapa consiste em imprimir no cabelo a forma desejada: lisa ou
ondulada. Após se lavar toda a solução de ácido tioglicólico e se enrolar ou
esticar o cabelo, o cabelereiro, então, oxida os grupos RSH para RSSR, com a
aplicação de um agente oxidante, tal como o peróxido de hidrogênio (H2O2,
água oxigenada) ou borato de sódio (Na2B4O7)
(os cabelereiros se referem a esta solução como "neutralizante"). O novo
padrão imposto, então, dura até o crescimento do cabelo, quando será uma
nova visita ao salão.
Como o cabelo pode ser colorido?
Existem, basicamente, 2 métodos: o primeiro consiste na incorporação de pigmentos na formação do fio de cabelo. Este processo é lento e, em geral, é feito com pigmentos naturais, tais como o encontrado na henna ou na camomila. Devido ao uso constante, em xampus e/ou condicionadores, estes pigmentos começam a fazer parte dos novos fios de cabelos formados.
O segundo método é a pintura imediata do cabelo, com a destruição dos pigmentos (descoloração) já existentes nos fios, e a incorporação de novos pigmentos. O processo de descoloração é ainda feito, na maioria das vezes, com peróxidos ou amônia, embora ambos os produtos sejam tóxicos. Um dos pigmentos mais utilizados, na coloração, é o acetato de chumbo, embora também seja tóxico.
As indústrias investem muito em
pesquisa nesta área. Recentemente, a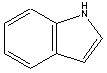 americana L'Oréal chegou a uma solução original para o tratamento de
cabelos grisalhos: desenvolveu um produto a base de dihidróxido-5-6-indol,
um precursor natural da melanina, o principal pigmento do cabelo. A figura
ao lado ilustra o indol, o reagente de partida para a síntese do
produto da LÓréal.
americana L'Oréal chegou a uma solução original para o tratamento de
cabelos grisalhos: desenvolveu um produto a base de dihidróxido-5-6-indol,
um precursor natural da melanina, o principal pigmento do cabelo. A figura
ao lado ilustra o indol, o reagente de partida para a síntese do
produto da LÓréal.
Como agem os xampus e condicionadores?
 Ambos
possuem, em sua formulação, moléculas de surfactantes. Os xampus e
condicionadores diferem, basicamente, na carga do surfactante: os
xampus contém surfactantes aniônicos, enquanto que os condicionadores têm
surfactantes catiônicos. Quando o cabelo está sujo, ele contém óleo em
excesso e uma série de partículas de poeira e outras sujeiras que aderem à
superfície do cabelo. Esta mistura é, geralmente, insolúvel em água - daí a
necessidade de um xampu para o banho. O surfactante
Ambos
possuem, em sua formulação, moléculas de surfactantes. Os xampus e
condicionadores diferem, basicamente, na carga do surfactante: os
xampus contém surfactantes aniônicos, enquanto que os condicionadores têm
surfactantes catiônicos. Quando o cabelo está sujo, ele contém óleo em
excesso e uma série de partículas de poeira e outras sujeiras que aderem à
superfície do cabelo. Esta mistura é, geralmente, insolúvel em água - daí a
necessidade de um xampu para o banho. O surfactante
![]() ajuda
a solubilizar as sujeiras, e lava o cabelo.
ajuda
a solubilizar as sujeiras, e lava o cabelo.
Um problema surge do fato de que
surfactantes aniônicos formam complexos estáveis com polímeros neutros ou
proteínas, como é o caso da queratina. O cabelo, após o uso do xampu, fica
carregado eletrostaticamente, devido a repulsão entre as moléculas de
surfactantes (negativas) "ligadas" à queratina. É aí que entra o
condicionador: os surfactantes catiônicos interagem fracamente com polímeros
e proteínas neutras, e são capazes de se agregar e arrastar as
 moléculas
de xampu que ainda estão no cabelo. Nos frascos de condicionadores existem,
ainda, alguns produtos oleosos, para repor a oleosidade ao cabelo, que foi
extraída com o xampu.
moléculas
de xampu que ainda estão no cabelo. Nos frascos de condicionadores existem,
ainda, alguns produtos oleosos, para repor a oleosidade ao cabelo, que foi
extraída com o xampu.
O cabelo, após o condicionador, fica menos carregado e, ainda, com mais
oleosidade.
Segundo este critério, não existe xampu "2 em 1", ou seja, uma formulação capaz de conter tanto um surfactante aniônico como um catiônico. Os produtos encontrados no mercado que se dizem ser "xampu 2 em 1" são, na verdade, xampus com surfactantes neutros ou, ainda, surfactantes aniônicos com compostos oleosos, que minimizam o efeito eletrostático criado pelo xampu normal.
|
Violência, miséria, injustiças. O
que torna a vida tão bonita, tão desejada apesar disso tudo? Não
há a menor dúvida: é o amor... Pela lente do amor as pessoas
enxergam um mundo mais florido, repleto de possibilidades de dar
certo. O amor é plenitude, é êxtase. Quando uma pessoa está
amando ela se torna mais gentil, alegre, adquire um ar sonhador
e vive rindo à toa. O problema é que se o amor não for bem
administrado, ele pode levar a pessoa a atitudes "quase"
ridículas.
Se suportarem a falta de emoções
intensas e decidirem continuar juntos, o cérebro passará a
aumentar gradualmente a produção de endorfinas. As endorfinas
atuam como calmante, são analgésicos naturais e proporcionam
sentimentos de segurança, paz e tranquilidade. Quem diria, hein?
A diferença entre uma paixão torrencial e um amor maduro é
simplesmente uma questão de liberar a substância certa! A
oxitocina também desempenha um papel importante em nossa vida
amorosa. Trata-se de um hormônio produzido na hipófise (uma
glândula situada no cérebro) cujas funções principais são:
sensibilizar os nervos e simular contrações musculares (a
secreção de oxitocina é o que leva ao clímax no ato sexual).
Além disso, esse hormônio estimula as contrações uterinas da
mulher durante parto, leva a liberação de leite e parece que
induz as mães a acariciarem e cheirarem seus bebês.
|

Depois de explodir na Europa e nos EUA, chega ao Brasil uma substância que já conquistou milhões de usuários. O ecstasy é a droga do momento: centenas de jovens, embalados por músicas e luzes, consomem esta substância, em raves e boates, com uma metodologia que lembra os antigos rituais de uso de drogas nos povos antepassados. O que torna esta molécula tão especial?
Centenas de jovens alucinados, cujo
slogan é "Set U Free". Este é o cenário de uma rave, festa de jovens e adolecentes embalada por techno,
luzes e o ecstasy. O MDMA (N-Metil-3,4-metilenodioxiamfetamina,
comumente conhecido como Ecstasy, X, E, XTC, Adam, entre outros) é uma droga
com intensa atividade psicotrópica. Na sua forma pura, é um pó branco
cristalino. É usualmente vendida na forma de pó, misturado com excipientes,
comprimidas em drágeas ou em cápsulas.
cenário de uma rave, festa de jovens e adolecentes embalada por techno,
luzes e o ecstasy. O MDMA (N-Metil-3,4-metilenodioxiamfetamina,
comumente conhecido como Ecstasy, X, E, XTC, Adam, entre outros) é uma droga
com intensa atividade psicotrópica. Na sua forma pura, é um pó branco
cristalino. É usualmente vendida na forma de pó, misturado com excipientes,
comprimidas em drágeas ou em cápsulas. O custo médio é de 20 a 30 dólares por cápsula. É ilegal na maioria dos
países. Pertence a classe das feniletilaminas, da qual fazem parte as
anfetaminas, a adrenalina, a dopamina e a mescalina.
Outros derivados sintéticos da anfetamina, como a efedrina, são vendidos
livrementes nas farmácias, em descongestionantes nasais, inibidores de
apetite, entre outros.
O custo médio é de 20 a 30 dólares por cápsula. É ilegal na maioria dos
países. Pertence a classe das feniletilaminas, da qual fazem parte as
anfetaminas, a adrenalina, a dopamina e a mescalina.
Outros derivados sintéticos da anfetamina, como a efedrina, são vendidos
livrementes nas farmácias, em descongestionantes nasais, inibidores de
apetite, entre outros.
O mecanismo de ação é o mesmo da
grande maioria das drogas tipo- anfetamina:
é a potencialização dos sistemas nervosos central e periférico, devido ao
aumento na produção de acetilcolina. Acetilcolina é um dos
neurotransmissores, moléculas que transmitem sinais químicos entre os
neurônios. Mas os principais efeitos mentais que o MDMA provoca devem-se a
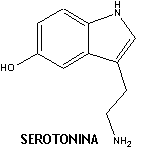
sua interferência no sistema da 5-hidroxitriptamina (serotonina, ou
5-HT). É o mesmo sítio ativado por drogas psicodélicas.
anfetamina:
é a potencialização dos sistemas nervosos central e periférico, devido ao
aumento na produção de acetilcolina. Acetilcolina é um dos
neurotransmissores, moléculas que transmitem sinais químicos entre os
neurônios. Mas os principais efeitos mentais que o MDMA provoca devem-se a
sua interferência no sistema da 5-hidroxitriptamina (serotonina, ou
5-HT). É o mesmo sítio ativado por drogas psicodélicas.
 Sabe-se
que o MDMA aumenta a biodisponibilidade do 5-HT, por dificultar a sua
recaptação e estimular a sua liberação pelos neurônios pré-sinápticos. O 5-HT
está associado a vários fatores no cérebro, como o sono, sonho, humor,
euforia, percepção sensorial, etc.. O MDMA provoca uma liberação massiva de
5-HT e, por isso, apresenta um forte efeito sobre o humor. Após algum
tempo, o estoque de 5-HT vai acabando e a biossíntese não atende a demanda.
Chega-se ao estado de depressão e esgotamento, que ocorre entre 6 a 8 horas
após a ingestão da droga.
Sabe-se
que o MDMA aumenta a biodisponibilidade do 5-HT, por dificultar a sua
recaptação e estimular a sua liberação pelos neurônios pré-sinápticos. O 5-HT
está associado a vários fatores no cérebro, como o sono, sonho, humor,
euforia, percepção sensorial, etc.. O MDMA provoca uma liberação massiva de
5-HT e, por isso, apresenta um forte efeito sobre o humor. Após algum
tempo, o estoque de 5-HT vai acabando e a biossíntese não atende a demanda.
Chega-se ao estado de depressão e esgotamento, que ocorre entre 6 a 8 horas
após a ingestão da droga.
Os efeitos da droga MDMA no organismo são
muito pronunciados, variando desde o estímulo até o relax. As droga
potencia os estímulos sensoriais; por isso, nas raves, os usuários
encontram um ambiente perfeito, cheio de música e luzes. Na psiquiatria, o
MDMA era utilizado para surtir os mesmos efeitos que, hoje, são causados
pelo Prozac (fluoxetina), conhecida como a droga da felicidade. As pessoas
ficam eufóricas, agitadas, mais emotivas e pré-dispostas ao carinho, toque e
sexo.
 Muitos
usuários relatam efeitos desconfortáveis, como cólicas, vômito e paranóias.
Algumas pessoas ficam deprimidas nos dias posteriores a ingestão da droga.
Entretanto, um dos piores e mais perigosos efeitos colaterais causados pelo
ecstasy é a súbita elevação da temperatura corpórea (o MDMA provoca
hipertermia). Isto pode causar uma desidratação profunda e, em muitos casos,
levar à morte. Nas raves, os usuários costumam ingerir litros de água,
tentando resfriar e hidratar o corpo. Embora não muito prejudicial a curto
prazo, o MDMA apresenta sérias injúrias a longo prazo. Uma delas é a
diminuição do peso do usuário, uma vez que o MDMA inibe o apetite e provoca
um grande desgaste calórico. Existem vários artigos que evidenciam, também,
a relação entre o uso do MDMA e distúrbios cardio-vasculares.
Muitos
usuários relatam efeitos desconfortáveis, como cólicas, vômito e paranóias.
Algumas pessoas ficam deprimidas nos dias posteriores a ingestão da droga.
Entretanto, um dos piores e mais perigosos efeitos colaterais causados pelo
ecstasy é a súbita elevação da temperatura corpórea (o MDMA provoca
hipertermia). Isto pode causar uma desidratação profunda e, em muitos casos,
levar à morte. Nas raves, os usuários costumam ingerir litros de água,
tentando resfriar e hidratar o corpo. Embora não muito prejudicial a curto
prazo, o MDMA apresenta sérias injúrias a longo prazo. Uma delas é a
diminuição do peso do usuário, uma vez que o MDMA inibe o apetite e provoca
um grande desgaste calórico. Existem vários artigos que evidenciam, também,
a relação entre o uso do MDMA e distúrbios cardio-vasculares.

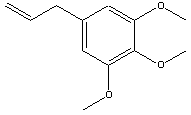
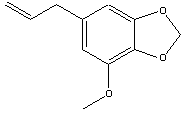
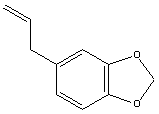
A síntese do MDMA é relativamente simples, e diversos usuários acabam "aprendendo" a metodologia, que consiste em vários refluxos, extrações, destilações e recristalizações. Uma das rotas sintéticas está esquematizada na figura abaixo. Neste exemplo, o reagente de partida é o safrol, que pode ser extraído do sassafrás. O safrol sofre uma isomerização, resultando na mistura cis-trans do isosafrol. Este é oxidado, na presença de peróxido, para uma cetona. Esta sofre uma aminação redutiva com a formamida, resultando no MDMA.
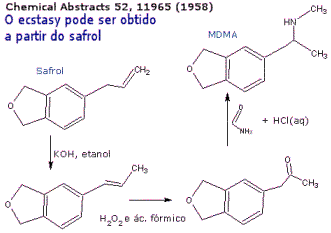
O safrol é o reagente de partida para vários análogos da anfetamina e, por isso, tem a sua venda controlada, no Brasil. Existe uma lei ambiental que, também, proíbe a exploração da sassafrás para a obtenção de safrol. Pesquisadores da Epagri já estão condicionando uma planta do norte, a pimenta longa, também rica em safrol, para o plantio em outras áreas do país. O safrol é muito utilizado nas indústrias de cosméticos, pesticidas/herbicidas, farmacêuticas e alimentos.
 Desde
os tempos mais remotos, o homem tem se utilizado de substâncias químicas,
encontradas em plantas ou, mais recentemente, sintéticas, para provocar
alterações no seu estado mental.
Desde
os tempos mais remotos, o homem tem se utilizado de substâncias químicas,
encontradas em plantas ou, mais recentemente, sintéticas, para provocar
alterações no seu estado mental.
 Algumas
vezes associadas a cultos religiosos, ritos espirituais ou práticas de
iniciação, as drogas sempre fascinaram a humanidade. Por serem capazes de
alterar profundamente a personalidade e interesses humanos, algumas drogas,
com o passar dos anos, se tornaram ilícitas. Outras, entretanto, como o
etanol, a nicotina e a cafeína, continuam legais, fazendo com que
determinados grupos na sociedade se enriqueçam cada vez mais, a despeito dos
males consequentes do uso deliberado destas drogas. A linha que separa as
drogas lícitas das ilícitas é tênue e, muitas vezes, imaginária. Muito
mais do que embasamento científico, esta distinção se faz com base em
parâmetros comerciais: qual presidente seria corajoso o suficiente para, por
exemplo, banir o álcool ou a nicotina de seu país? O ecstasy é apenas mais
uma droga, destas que costumam aparecer a cada geração. Com o acentuado
avanço da química orgânica nas últimas décadas, não será surpresa se, nos
próximos anos, novas substâncias, com efeitos diversos, sejam escolhidas
pelos jovens e adolescentes como novas portas para a fuga da realidade.
Algumas
vezes associadas a cultos religiosos, ritos espirituais ou práticas de
iniciação, as drogas sempre fascinaram a humanidade. Por serem capazes de
alterar profundamente a personalidade e interesses humanos, algumas drogas,
com o passar dos anos, se tornaram ilícitas. Outras, entretanto, como o
etanol, a nicotina e a cafeína, continuam legais, fazendo com que
determinados grupos na sociedade se enriqueçam cada vez mais, a despeito dos
males consequentes do uso deliberado destas drogas. A linha que separa as
drogas lícitas das ilícitas é tênue e, muitas vezes, imaginária. Muito
mais do que embasamento científico, esta distinção se faz com base em
parâmetros comerciais: qual presidente seria corajoso o suficiente para, por
exemplo, banir o álcool ou a nicotina de seu país? O ecstasy é apenas mais
uma droga, destas que costumam aparecer a cada geração. Com o acentuado
avanço da química orgânica nas últimas décadas, não será surpresa se, nos
próximos anos, novas substâncias, com efeitos diversos, sejam escolhidas
pelos jovens e adolescentes como novas portas para a fuga da realidade.
|
Noz Moscada:
uma droga alucinógena |
 Muitas
plantas possuem compostos cujas estruturas químicas lembram o MDA (metilenodioxianfetamina).
Entre estes, o sassafrás, a salsa, o açafrão, anis e a noz moscada.
Assim como o MDA, suas estruturas lembram a anfetamina, a dopamina e
a mescalina. Os seus efeitos também são parecidos com os destas
drogas: algumas causam euforia e outras alucinações. Muitas
plantas possuem compostos cujas estruturas químicas lembram o MDA (metilenodioxianfetamina).
Entre estes, o sassafrás, a salsa, o açafrão, anis e a noz moscada.
Assim como o MDA, suas estruturas lembram a anfetamina, a dopamina e
a mescalina. Os seus efeitos também são parecidos com os destas
drogas: algumas causam euforia e outras alucinações. A noz moscada, que é a semente da planta Myristica fragrans, é largamente utilizada como tempero, no mundo inteiro. Entretanto, por conter compostos tipo-MDA, é também utilizada como uma droga alucinógena, principalmente por adolecentes e presidiários. A noz moscada já era utilzada com fins medicinais desde o sétimo século A.C., por médicos árabes. Entretanto, o primeiro relato de efeito psicotrópico da noz moscada foi somente em 1576, na descrição de uma "pregnant English lady who, having eaten ten or twelve nutmegs, became delirously inebriated".
Componentes do óleo de Noz Moscada:
|
HISTÓRICO
1913:
O MDMA é sintetizado e patenteado pela MERCK. A patente não menciona o uso.
1953: Exército norte-americano testa a droga para aplicações
militares. Chegou a ser utilizada como "droga da verdade".
1977: Alexandre Shulgin, após obter o PhD em Bioquímica, testa o MDMA
e relata a experiência a alguns amigos
 1978:
O primeiro artigo científico sobre o MDMA foi publicado, por Alexandre
Shulgin. Inicia-se o uso terapêutico do MDMA, por psiquiatras europeus e
norte-americanos.
1978:
O primeiro artigo científico sobre o MDMA foi publicado, por Alexandre
Shulgin. Inicia-se o uso terapêutico do MDMA, por psiquiatras europeus e
norte-americanos.
1977-1985: A "era dourada" do MDMA. Como não era ilegal, podia ser
vendido livremente nas ruas, boates, bares, farmácias e danceterias. Muitos
estudantes norte-americanos usavam diariamente. Em 1984 o MDMA ganhou um
apelido: "empathy" que, logo depois, transformou-se em "ecstasy".
1980: O ecstasy chega à Europa. A droga foi logo adotada por muitos
jovens, principalmente na Inglaterra.
01/06/1985: O MDMA é, finalmente, banido e considerado ilegal nos
EUA. O congresso americano o colocou no topo da lista de drogas proibidas:
inicialmente, até mesmo a pesquisa acadêmica da droga ou derivados foi
suspensa. Logo, a grande maioria dos países sul-americanos e europeus também
baniram o ecstasy.
08/02/2000: Dois estudantes de química da Universidade Federal do
Paraná e um professor de colégio foram presos por fabricar e vender ecstasy.
Segundo a polícia, o professor Daniel Gibson teria encontrado a rota
sintética da droga em uma página na Internet.
05/06/2000: Manuela Kirschner, filha do embaixador brasileiro em
Londres, e seu namorado, Chrystian von Rogoschin, foram presos em flagrante
ao receber um pacote com 260 comprimidos de ecstasy. Mais um caso de tráfico
de drogas entre jovens de classe alta do DF.
|
Saiba mais
|
| >
ecstasy.org: tudo
sobre o MDMA > Ecstasy e o seu Cérebro > E is for Ecstasy: um livro online > MDMA e análogos > + Feniletilaminas > Um tutorial sobre XTC |
ATENÇÃO
O uso de drogas psicotrópicas é prejudicial à saúde, pois causa dependência.
O lança-perfume é um produto desodorizante com aroma aproximado do perfume L'Air Du Temps de Nina Ricci em forma de um spray. O líquido, que é a base de cloreto de etila (H3C-Cl) e acondicionado sob pressão em ampolas de vidro, devido a combinação do gás e perfume, ao ser liberado, forma um fino jato com efeito congelante.
A Lança perfume foi industrializada pela Rhodia da Argentina e importado para o Brasil do início e até meados do século XX. A marca Rodouro foi muito solicitada nos carnavais brasileiros, até que os foliões passaram a utilizá-la como bebida espirituosa ou inalá-la profundamente, a partir de então, foi proibido o uso em salões e mais adiante a sua importação.
Como na Argentina ninguém bebe "perfumes" e nem cheira gasolina (que também contem os compostos) os produtos continuam até hoje liberados e não são considerados de efeito tóxico e sim analgésico.
História
O lança-perfume aparece no Carnaval de 1906, no Rio de Janeiro, sendo rapidamente incorporada aos festejos carnavalescos de todo o Brasil, principalmente nas batalhas de confete, corsos e, mais tarde nos bailes carnavalescos. É a droga considerada símbolo do Carnaval.
Durante muito tempo o lança-perfume foi uma diversão inocente, mas, pouco a pouco, passou a ser inalado durante os bailes como uma droga.
Após alguns casos de morte de usuários, por embriaguez seguida de queda em janelas. Em 1961, por recomendação do jornalista Flávio Cavalcante seguido de um decreto do então Presidente, Jânio Quadros a lança perfume fabricado pela Rhodia na Argentina acabou sendo proibido no Brasil.
No entanto, até 2 anos atrás continuou sendo uma droga encontrada com facilidade em diversos estados brasileiros. Agora não é mais encontrado pois o que tudo indica a suposta indústria situada na Argentina fechou ou parou de fabricar tal produto (porém ainda traficam esse produto).
Uma série de falsos boatos sobre a droga sempre existiu, como por exemplo de que a droga era vendida em supermercados na Argentina.
Curiosidade: Drogas inalantes são conhecidas em todo o mundo, entretanto o lança perfume, a cola de laminados (sapateiro) são usados apenas no Brasil, mesmo na Argentina e Paraguai que seriam os "fabricantes" de lança perfume, o uso não é popular e a maioria das pessoas nem conhece tal produto, indicando que é industrializado somente para exportação.
Características técnicas
O lança-perfume é uma droga manufaturada com solventes químicos a base de cloreto de etila. A versão caseira chamado de "loló" é feita com uma combinação de éter(25%), clorofórmio CHCl3 (45%), álcool de cereais e/ou acetona(25%) e essência perfumada(5%).
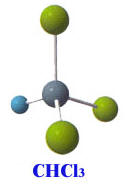
Clorofórmio é um líquido volátil, extremamente tóxico e pode ser fatal se for aspirado ou inalado. Causa irritação à pele, olhos e trato respiratório. Afeta o sistema nervoso central, rins, sistema cardiovascular e fígado. Pode causar câncer dependendo do nível e duração de exposição. Faz parte da composição do entorpecente chamado "lóló" (lança-perfume).
O produto industrializado é geralmente embalado em tubos na forma líquida mediante alta pressão. O líquido, em contato com o ar, evapora rapidamente.
O lança-perfume acelera a freqüência cardíaca, podendo chegar até 180 batimentos por minuto. Aparentemente inofensiva devido ao seu odor, esta droga destrói as células do cérebro e pode levar o usuário a ter desmaios ou em caso extremos até à morte através de parada cardíaca.
Efeitos
Os efeitos do Lança-Perfume podem variar conforme a quantidade inalada pelo usuário, ele age no sistema nervoso central e causa desde um pequeno zumbido até fortes alucinações, inicia 5 à 10 segundos após a inalação da droga e dura de 30 segundos a até 10 minutos.
| Euforia e excitação. | |
| O tato é alterado e pode levar a uma sensação de "estar voando". | |
| Formigamento das extremidades, no caso, mãos e pés. | |
| Formigamento da face. | |
| Forte barulho no ouvido, na maioria dos casos e como uma das características da droga, o famoso "Tuim" (semelhante ao barulho de uma linha telefônica aguardando uma chamada), e com o uso continuo da droga algumas pessoas escutam o barulho semelhante o de um helicóptero (vum vum vum), ou o de uma ambulância. | |
| Sensação de felicidade. | |
| Vontade de rir. | |
| Alucinações: se inalado em grandes quantidades a pessoa perde os sentidos, tem alucinações, sonhos, mas podendo sempre sofrer sérios danos causados por quedas ou por agir inconscientemente. | |
| Após o efeito da droga, segue náuseas, depressão, dores de cabeça e mal estar. | |
| No dia seguinte ou algumas horas depois podem surgir dores no estômago e uma sensação semelhante a uma ressaca. | |
| Se inalado em grande quantidade, há uma forte tendência do usuário cuspir placas de sangue. | |
| Se misturado a bebida pode causar coma profundo. | |
| Se você chegar ao ponto de desmaiar, terá sonhos alucinantes e ao acordar não se recordará de nada e ficara "lesado" por um tempo,como se fosse uma espécie de ressaca. |
Pesquisas indicam que o uso não causa dependência física,
mas pode causar dependência psicológica e danos sérios ao
sistema nervoso.
Abstinência
Os inalantes ou delirantes não causam dependência física, mas, o mesmo não se pode afirmar da psicológica e da tolerância. Depois de absorvidos pela mucosa pulmonar, essas substâncias são levadas para o sistema nervoso central, fígado, rins, medula óssea e cérebro, causando neste último o bloqueio da transmissão nervosa. Para os indivíduos já viciados, a síndrome de abstinência, embora de pouca intensidade, está presente na interrupção abrupta do uso dessas drogas, aparecendo ansiedade, agitação, tremores, câimbras nas pernas, insônia e perda de outros interesses que não seja o de usar solvente. A tolerância pode ocorrer, embora não tão dramática quanto de outras drogas.
Saiba um pouco mais...
Uma versão tupiniquim do lança- perfume é um produto muito conhecido pelos adolescentes, é o "cheirinho" ou "loló" ou ainda " cheirinho da loló". Este é um preparado clandestino, à base de clorofórmio mais éter. Mas sabe-se que quando estes "fabricantes" não encontram uma daquelas duas substâncias misturam qualquer outra coisa em substituição, o que traz complicações quando se tem casos de intoxicação aguda por esta mistura. Um outro inalante do gênero é poppers. Vendido em sex shops europeus, e com a propriedade de aguçar a excitação, é usado principalmente por gays que o aspiram no momento do orgasmo. É raro no Brasil. São vários os tipos de inalantes, os mais simples e baratos são os mais utilizados, e podem ser: gasolina, adesivos, fluido para isqueiro, acetona, cola de sapateiro, massa plástica clorofórmio, lança perfume, éter, spray para cabelos e desodorantes.
|
Quem congela primeiro: água quente ou água fria?
|
Este site foi atualizado em 04/03/19