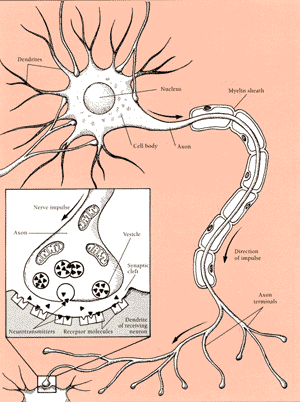
|
Categoria: Desfolhante.
O Agente laranja é uma mistura de dois herbicidas: o 2,4-D e o 2,4,5-T. Foi
usado como desfolhante pelo exército americano na Guerra do Vietnã.
Derrubava as folhas das árvores, impedindo que os soldados se escondam na
mata. Causa sérios danos ao meio ambiente. Ambos os constituintes do Agente
Laranja tiveram uso na agricultura, principalmente o 2,4-D vendido até hoje
em produtos como o Tordon. Por questões de negligência e pressa para
utilização, durante a Guerra do Vietnam, foi produzido com inadequada
purificação, apresentando teores elevados de um subproduto cancerígeno da
síntese do 2,4,5-T: a dioxina tetraclorodibenzodioxina. Este resíduo não é
normalmente encontrado nos produtos comerciais que incluem estes dois
ingredientes, mas marcou para sempre o nome do Agente Laranja, cujo uso
deixou seqüelas terríveis na população daquele país e nos próprios soldados
americanos.
Aviões espalhando agente laranja no Vietnam
Calcula-se que tenham sido lançados 45,6 milhões de litros do produto durante os anos 60, cobrindo dez por cento do território do Vietnam.
Um helicóptero UH-1D espalhando agente laranja em uma floresta na região do delta do Mekong (1969)...
Em
1984, uma ação judicial movida por veteranos de guerra americanos contra as
companhias químicas fornecedoras do Agente Laranja resultou em um acordo de
93 milhões de dólares em indenizações aos soldados. Esta ação foi arquivada
pela seguinte sentença "Não há base legal para qualquer das alegações sob as
leis domésticas de qualquer país, nação ou estado ou sob qualquer forma de
lei internacional".
Algumas Vitimas do Agente Laranja
Os efeitos da dioxina usada no desfolhante [herbicida] Agente Laranja continuam na região que compreende áreas do Vietnam, Laos e Camboja
Os resíduos se entranham na terra e nas sementes das plantas

E os que as consumiram e consomem transmitiram
E transmitem seus efeitos aos descendentes
Categoria:
Asfixiante...
Ocorrência: O cloro é um elemento bastante abundante na litosfera,
estimando-se a sua parcela em massa em 0,045 %. Devido à sua elevada
afinidade para os outros elementos, o cloro nunca ocorre no estado livre,
exceto numa parte ínfima de gases vulcânicos.
De entre os minerais que contém cloro, os mais comuns são a halite (NaCl), a
silvite (KCl) e a carnalite (MgCl2.KCl.6H2O). Para
além de se encontrarem vastamente dispersos na litosfera, os sais de cloro
estão também dissolvidos na hidrosfera. Aqui o cloreto de sódio é, sem
dúvida, o composto deste elemento mais abundante, estimando-se a sua
concentração na água do mar em cerca de 2,6 %. O cloreto de sódio tem um
função vital na dieta humana, sendo vulgarmente conhecido por sal de mesa. O
seu valor é de tal modo reconhecido pelas civilizações que o sal chegou
mesmo a ser uma unidade monetária, reconhecendo-se o seu nome na raíz
etimológica da palavra "salário".
O gás cloro foi pela primeira vez preparado por Scheele em 1774, ao aquecer
ácido clorídrico com dióxido de manganésio. Era libertado um gás amarelo
esverdeado que Scheele pensou ser um composto. Lavoisier batizou a nova
substância de ácido oximuriático pois pensava que ele era formado pela
adição de oxigénio ao ácido clorídrico de uma maneira análoga à conversão do
ácido sulfuroso em ácido sulfúrico por oxidação (note-se que Lavoisier
acreditava que todos os ácidos continham oxigénio). Esta interpretação
errónea foi consolidada pela investigação de Berthollet que, em 1785,
verificou que, quando uma solução aquosa de cloro era colocada à luz do sol,
libertava oxigênio.
Os químicos Gay-Lussac e Thénard, em 1809, passaram o gás puro e seco por
carbono ao rubro mas não o conseguiram separar em componentes. Davy, em
1810, tentou novamente decompor o gás, tendo as suas tentativas falhado e
provando, assim, que o ácido oximuriático de Lavoisier era uma substância
elementar. Chamou-lhe cloro, do grego "Khloros", que significa
amarelo esverdeado.
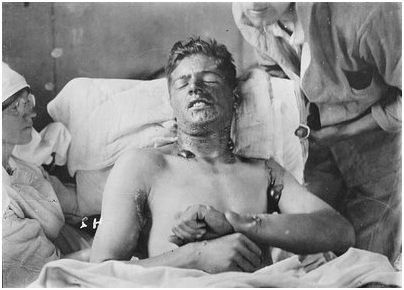
Soldados em 1915 com mascaras para proteger do Gás de Cloro. Detalhe até o jumentinho com mascara. Notem a fumaça na foto eis o gás de cloro em ação...
Em 1915, durante a Primeira Guerra Mundial, o cientista alemão Fritz Haber teve a idéia de usar gás cloro para obrigar as tropas inimigas a sair das trincheiras e aceitar o combate a céu aberto. Os alemães lançaram gás cloro no front perto da cidade belga de Ypres. Foi uma devastação — 5 mil soldados franceses desprevenidos foram mortos e outros 10 mil ficaram feridos.
O soldado à esquerda sofrendo asfixia pelo Gás de Cloro e seus companheiros com as mascaras, uma imagem brutal
O que causa: O cloro pertence ao grupo dos gases sufocantes, que irritam e ressecam as vias respiratórias. Para aliviar a irritação, o organismo segrega líquido nos pulmões, provocando um edema. A vítima morre literalmente afogada nos próprios fluídos.

Uma imagem de um soldado morto possivelmente por asfixia como mostra seu
esqueleto com a mão esquerda sobre o pescoço
Tratamento: Inalação de oxigênio úmido e intubação traqueal ou traqueostomia em pacientes com obstrução das vias aéreas ou hipoxemia grave.
O ácido
cianídrico é um gás incolor que mata imediatamente se inalado numa
concentração superior a 300 mg/m³ de ar. Durante a Segunda Guerra Mundial,
foi utilizado pelos nazistas para o extermínio de judeus em câmaras de gás.
Uma curiosidade: o cianeto de potássio, quando ingerido, reage com a
acidez do estômago e gera gás cianídrico. Por isso, foi utilizado na Segunda
Guerra Mundial como uma alternativa de suicídio rápido em situações de
emergência. O líder nazista Goering, por exemplo, suicidou-se engolindo uma
cápsula de cianeto pouco antes de ser levado ao enforcamento em Nuremberg.
Categoria: Agente do sangue.
O que causa: Combina-se com a hemoglobina, bloqueando a capacidade do
sangue de transportar oxigênio. Provoca a morte rapidamente quando inalado.
Tratamento: A ação do gás cianídrico é muito rápida. O tratamento só
é possível se a quantidade inalada não atingir a concentração fatal. O Na2S2O3
aplicado por via intravenosa reage com o cianeto, formando sulfocianeto, que
é atóxico e eliminado pela urina. Outros produtos podem ser usados, como 4-dimetilaminofenol,
piruvato de sódio e oxigenoterapia.
Camara de Gás
A Câmara de gás é um dos suportes utilizados pela justiça para execução de
condenados a morte.
Contam os registros históricos que na Alemanha nazista na II Guerra Mundial
essas câmaras eram muito solicitadas, em campos de extermínio (em Varsóvia)
do lado Polonês na eliminação sistemática de seus prisioneiros.
Ruínas da câmara de gás do campo de extermínio Auschwitz-Birkenau
Nestas câmaras, hermeticamente vedadas, um poderoso e mortal gás chamado Zyklon B era injetados em quantidades no interior. O "Zyklon B" era o nome comercial, mas na verdade, tratava-se do ácido cianídrico um gás muito utilizado até hoje nas câmaras de gás norte americanas. O ácido cianídrico usado para esse fim é uma pastilha forma cristais que uma vez exposto ao ar entra em processo de sublimação e após algumas horas começa a liberar o gás mortífero e altamente letal quando inalado. Para se ter uma idéia, mesmo em pequenas doses, ao ser respirado o gás cianídrico entra pela corrente sanguínea, até chegar às células, onde bloqueia a ação das mitocôndrias e desse modo, as células ficam sem produzir energia ocorrendo a seguir a morte por asfixia. O gás também é usado em grandes celeiros na eliminação do caruncho (pragas).
Zyklon B
Este gás foi
inicialmente utilizado como pesticida, para matar piolhos, pulgas e
carrapatos transmissores de tifo, que era uma doença endêmica na época da
segunda guerra. A casa ou alojamento com pragas eram bem fechadas e os
cristais eram jogados em seu interior. Depois de seis horas, todos os
insetos estavam mortos. Fúnebre foi a descoberta de que o gás também era
tóxico para humanos e desse modo, os prisioneiros judeus eram confinados em
câmaras (grandes salas de concreto) muito bem lacradas e os cristais de
ácido cianídrico eram jogados em seu interior.
Ao contrário do que se imagina esse "processo de morte" não era rápido nem
indolor como na câmara de gás. A sublimação do gás cianídrico era lenta e
sua inalação e altamente sufocante. Homens e mulheres, novos e velhos, eram
levados para estas câmaras, sob o pretexto de tomar banho e não voltavam
mais.
Também era realizado um cuidadoso trabalho para que as vítimas realmente
pensassem que tomariam banho e sairiam de lá vivas: os alemães ordenavam que
todos tirassem as roupas e depois cada vítima recebia um cabide numerado
para que colocasse suas roupas para que depois do "banho", pudessem
reavê-las, e as pessoas eram obrigadas a levantar os braços ao entrar para
que assim houvesse mais espaço para acomodar mais pessoas, e antes de entrar
na câmara, as pessoas tinham seus cabelos cortados por prisioneiros que
habitavam o campo havia mais tempo, e em um espetáculo de sadismo, algumas
vezes, os alemães convocavam uma banda para entreter os prisioneiros antes
de levá-los para a câmara. Assim que as portas se fechavam, a luz era
apagada e o gás começava a invadir a câmara. Muitas vezes as paredes tinham
de ser lavadas cuidadosamente após cada utilização, pois no desespero,
várias pessoas se jogavam contra as paredes . A decisão de usar a câmara de
gás foi tomada na Conferência de Wansee, em 1942, e primeiramente usavam
monóxido de carbono (CO) do motor de um tanque. A última utilização das
câmaras de gás ocorreu em 1944, em Auschwitz-Birkenau, o mais tenebroso
campo de extermínio.
A câmara de gás é ainda uma forma de aplicação da pena de morte legalmente
permitida em alguns estados dos Estados Unidos, embora seja normalmente
utilizada para esse efeito a injeção letal. O último condenado executado por
este meio (até 2006) foi Walter La Grand, em 4 de Março de 1999, no Arizona.
Câmara de gás nos Estados Unidos
Categoria:
Agente Vesicante.
Os “Mostarda de Enxofre” ou simplesmente “Gás Mostarda” é um agente químico
vesicante, utilizado como arma. Quando em sua forma pura, é incolor, inodoro
e líquido à temperatura ambiente. Na forma comumente utilizada como arma
química, tem coloração marrom-amarelada e tem um odor que lembra a mostarda.
É conhecido por diversas nomenclaturas: HD, senfgas, Mostarda de Enfofre,
Gás Vesiculoso, s-lost, lost, Kampfstoff LOST (a abreviação LOST refere-se
aos nomes de Lommel e Steinkopf, que desenvolveram o processo de produção em
massa durante a Grande Guerra, para a companhia alemã Bayer AG.), Cruz
Amarela e Yperita.
Agentes Mostarda, são regulados atualmente pelo CWC (Chemical Weapons
Convention – Convenção de Armas Químicas) de 1993, incluídos na classe de
agentes químicos de alto risco.
Uso na Grande Guerra
Utilizado pela primeira vez em 1917, ficou conhecido como “Yperita” porque o
local onde se deu seu uso foi nas proximidades de Ypres. Após o ataque os
britânicos decidiram criar seu próprio arsenal de gás mostarda (mas o único
meio que lhes era possível à época era o processo Despretz–Niemann–Guthrie
), que foi utilizado pela primeira vez em setembro de 1918, durante o ataque
à Linha Hindenburg.
O gás era dispersado via aérea, em combinação com outros agentes químicos, o
que lhe atribuía a coloração amarelada e o odor característico. Lançado
através de granadas de artilharia, bombas aéreas, minas terrestres,
morteiros, obuseiros e mesmo foguetes, teve uma taxa de letalidade de apenas
1% dos casos.
Sua principal efetividade era como agente incapacitante, uma vez que não
existiam medidas de proteção eficazes contra a exposição deste agente. Mesmo
que o soldado esteja utilizando uma máscara, o agente ataca a pele.
Uma característica deste tipo de agente químico é o surgimento imediato dos
sintomas como vesículas e queimaduras. Em muitos casos, os efeitos
continuavam a surgir até 12 horas depois da exposição. Apesar de não ser a
intenção primária do uso deste tipo de agente, quando a exposição era
elevada, se tornava letal, causando a morte entre 3 e 5 minutos, o que
proporcionava ainda mais um estado de desorientação das tropas.

Quadro de Sargent 1918-1919 retratando vitimas do Gás Mostarda
Além disso
permanece ativo por um longo período. Quando o gás contaminava as vestes e
equipamentos de um soldado, os outros soldados que tinham algum contato com
este, também eram envenenados. Quando absorvido pelo solo, permanecia ativo
por diversas semanas, evaporando-se muito lentamente, mesmo à noite, o que
obrigava soldados de regiões muito contaminadas a abandonarem suas posições.
Os soldados expostos a este agente químico sofriam graves lesões nas áreas
expostas, sofriam cegueira temporária, vômitos, tinham os pulmões afetados,
geralmente causando inflamação nos brônquios, sofriam hemorragias internas
e/ou externas, causadas pelo rompimento de veias, tinham a mucosa atacada, o
que causava seu desprendimento e com isso mais sangramentos e uma dor
insuportável. Era comum nos hospitais, vítimas deste tipo de envenenamento,
serem abrigadas a ser amarradas à cama, tamanha a dor.
Apesar de não ser a intenção primária do uso deste tipo de agente, quando a
exposição era elevada, se tornava letal, causando a morte entre 3 e 5
minutos.
O numero de vitimais da guerra por Gás Mostarda são de aproximados 100 mil
mortos, 2 milhões de feridos e incapacitados.
Propriedades físicas
Temperatura de fusão: 13°C.
Temperatura de ebulição: 216°C.
Densidade: 1,274 g/mL.
Ele é pouco solúvel em água e muito solúvel em gorduras e lipídios.
Este composto é um veneno mortal, que provoca graves ulcerações e irritações
na pele, nos olhos e no sistema respiratório, além de lesões neurológicas e
gastrointestinais e destruição de tecidos e vasos sanguíneos.
Uma pessoa contaminada com gás mostarda, pode sentir os sintomas em pouco
minutos, dependendo da concentração a qual foi exposta.
Antídotos: Quando ele reage com o cloro, ou NaOCl, ou ainda, Ca(OCl)2,
ocorre a formação de compostos atóxicos. Sendo estas, reações para uma
possível descontaminação ou desativação do composto.
Algumas Vitimas
Soldado exposto ao gás mostarda em 1918
Vítima do gás mostarda
Soldado em 1918, mais uma vítima do gás mostarda
Soldados cegos pelo gás mostarda na Primeira Guerra Mundial
Mísseis Napalm
Napalm é um
conjunto de líquidos inflamáveis à base de Gasolina gelificada, utilizados
como armamento militar. O Napalm é na realidade o agente espessante de tais
líquidos, que quando misturado com gasolina a transforma num gel pegajoso e
incendiário.
Categoria: Agente carbonizante.
Origem: O Napalm foi desenvolvido em 1942 durante a Segunda Guerra
Mundial nos Estados Unidos por uma equipe de químicos da Universidade de
Harvard liderada por Louis Frieser. O nome Napalm deriva do acrônimo dos
nomes dos seus componentes originais, sais de Alumínio co-precipitados dos
ácidos Naftênico e Palmítico. Estes sais eram adicionados a substâncias
inflamáveis para serem gelificadas.
Um dos maiores problemas dos fluidos incendiários (Tais como os usados nos
lança-chamas) é que eles salpicam e escorrem muito facilmente devido à sua
baixa viscosidade. Nos Estados Unidos descobriu-se que a gasolina sob a
forma de gel aumentava o alcance e a eficiência dos lança-chamas. No
entanto, no início da Segunda Guerra Mundial, para se obter gasolina
gelificada era necessário usar borracha natural, a qual estava, na altura,
sob forte procura e com preço elevado. O Napalm veio providenciar uma
alternativa mais barata.
O Napalm moderno é composto por Benzeno e Poliestireno, e é conhecido por
Napalm-B.
Explosão de Napalm
Utilização:
O Napalm foi usado em lança-chamas e bombas pelos Estados Unidos e nações
aliadas, para aumentar a eficiência dos líquidos inflamáveis. A substância é
formulada para queimar a uma taxa específica e aderir aos materiais. O
Napalm é misturado com a gasolina gélida em diferentes proporções para
alcançar este objetivo.
Diversos lançadores foram desenvolvidos para seu uso, culminando nas armas
lança-chamas utilizadas contra os exércitos vietnamitas no final da década
de 1960.
Napalm sendo usado durante a guerra do Vietnam a partir de um barco patrulha
O napalm, em combustão, gera temperaturas superiores a 1.000 ºC.
B 29 jogando mísseis Napalm na Segunda Guerra Mundial
Na Segunda Guerra Mundial, a Força aliada bombardeou cidades do Japão com napalm. Foi usada também contra guerrilhas comunistas na Guerra civil Grega, pelas Forças armadas dos Estados Unidos foi usada na Coréia e na Guerra do Vietnã e pelo México em 1960 usada contra guerrilha de Guerrero.
Explosão de Napalm
Um outro
efeito do napalm em bombas, consiste na desoxigenação do ar envolvente e
aumento da concentração de Monóxido de Carbono os quais provocam asfixia .
Uma outra utilização do Napalm na Guerra do Vietnã consistiu na abertura de
clareiras para a aterrizagem de helicópteros.
Proibição: Em 1980, o seu uso foi proibido por uma convenção da
Organização das Nações Unidas.
Algumas Vitimas de Napalm
Homens carbonizados
Homem com o rosto queimado
Garoto com rosto e mãos queimados
Crianças correndo de uma bomba napalm, observe no desespero estampado no rosto das crianças
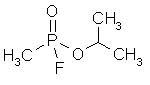
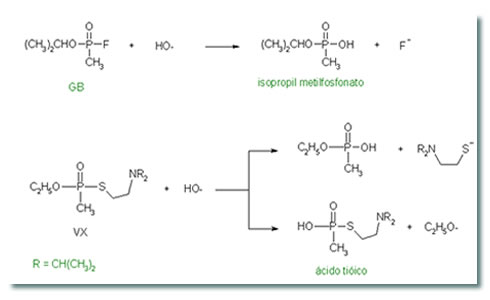
Sarin é um
composto altamente tóxico, tanto em sua forma líquida como gasosa.
Sarin (C4H10FO2P) é uma substância tóxica
que atua essencialmente sobre o sistema nervoso. Muito utilizada em guerra
química. O sarin é um composto organofosforado. Essa classe de compostos foi
sintetizada pela primeira vez em 1936 pelo químico Gerhard Schrader, que
tentava desenvolver pesticidas de uso agrícola. O caso mais recente de
utilização de sarin foi um atentado terrorista ao metrô de Tóquio, no Japão,
em 1995. A seita japonesa radical Verdade Suprema foi a responsável pelo
atentado, que deixou doze mortos e 5 mil feridos. O ataque era direcionado
contra comboios/trens passando por Kasumigaseki e Nagatachō, a casa do
governo japonês. Esta era (e até hoje) o mais grave atentado a ocorrer no
Japão desde o fim da Segunda Guerra Mundial.
Categoria: Agente dos nervos.
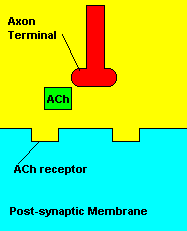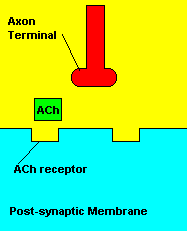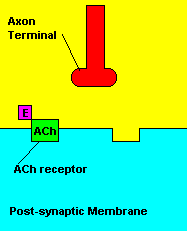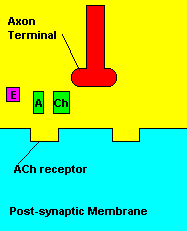
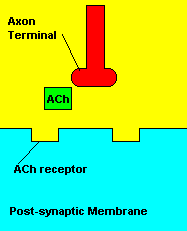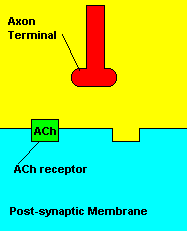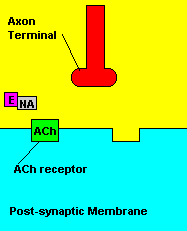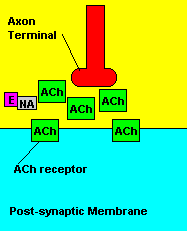
O que causa: Os compostos organofosforados agem sobre o sistema
muscular inibindo uma enzima pela degradação de um importante
neurotransmissor (acetilcolina) envolvido com a contração muscular. Os
sinais da intoxicação incluem: fortes contrações musculares, salivação
abundante, diminuição da frequência cardíaca; podendo ocassionar ação também
no sistema nervoso central, que resulta em convulsões, com alto índice de
mortalidade.
O que fazer: A providência imediata é de descontaminação, tirando a
roupa e irrigando bem olhos e pele com água. Hospitais em muitas comunidades
estão providenciando estoques de antídotos.
Antidoto: O tratamento deste tipo de exposição pode incluir, entre
outros, o uso da atropina - sulfato de atropina - para o combate de efeitos
periféricos e substâncias anticonvulsivantes, para os efeitos centrais.
Utilização: Uma vez produzido, o gás Sarin apresenta tanto um
problema de armazenamento como de distribuição. Nos anos 50 e 60, as armas
químicas militares, passaram a ser construídas tendo por base dois
reservatórios contendo composto não tóxicos, que são misturados (formando o
gás nervoso) durante o voo para o seu alvo.
Este último passo da reação que se dá em pleno voo é muito simples, o que
faz com que este tipo de munições binárias seja eficiente.
Outras armas químicas tais como o VX não permitem este tipo de
munições binárias o que faz com que seja muito mais perigoso o seu
armazenamento. No em ambos os casos é necessário equipamento especial para o
supervisionamento da zona de enchimento das munições e na zona de
armazenamento, para detectar qualquer fuga dos reservatórios.
As armas binárias podem ser disparadas utilizando artilharia convencional ou
sistemas mais avançados tecnologicamente.
A artilharia convencional tem uma capacidade de precisão relativamente
baixo, mesmo com a utilização de modernos sistemas de lançamento, pois uma
pequena variação na velocidade ou direcção do vento podem enviar a nuvem
altamente tóxica para o local de lançamento.
Tal como na guerra Irã Iraq, mísseis Scut ou outro tipo de armas balísticas
podem ser utilizadas para a entrega do gás para distâncias longínquas, este
sistema de entrega tem a vantagem de a explosão e dar a uma distância muito
grande do local de lançamento.
Um dos sistemas mais precisos para entregas de longo alcance são os mísseis
de cruzeiro. Este tipo de mísseis é extremamente preciso e podem desviar-se
de edifícios e outros obstáculos, são também extremamente difíceis de
atingir durante o voo.
Outro tipo de distribuição é o bombardeamento a partir de aviões, com a nova
tecnologia este tipo de bombardeamento é extremamente preciso. Neste caso a
principal desvantagem é a possibilidade de contagio do piloto.
Em suma Sarin é uma arma muito versátil que pode ser utilizada em muitos
campos de batalha, e pode ser entregue utilizando vários métodos dependendo
da situação e da quantidade desejada.
Ataque com Gás Sarin Japão 1995
Vítimas do gás sarin
Na foto: Shin Hirata, Katsuya Takahashi, Naoko Kikuchi, publicado no japão na epoca do ataque, eles são suspeitos de terem conexão com o ataque
Equipe de descontaminação
Equipe de descontaminação
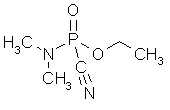
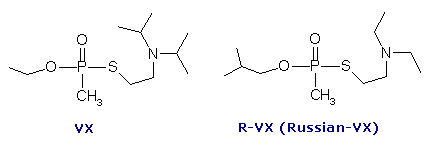
VX é
provavelmente um dos mais perigosos produtos químicos criados pelo homem. É
usado em guerra química. No filme "The Rock", era aquele líquido verde que
os terroristas ameaçaram com a Baía de San Francisco.
VX gás foi desenvolvido em Porton Down Armas Químicas Research Center,
Wiltshire, Inglaterra em 1952 e os seus efeitos devastadores foram testados.
Os britânicos negociaram a tecnologia do VX com os Estados Unidos da
América, para informações sobre armas termonucleares.
Sua fórmula química é CH3CH20-P(P)(CH3)-SCH2CH2N(C3H7)2
e está normalmente em seu estado líquido apesar do seu nome. Possui uma
baixa volatilidade, é inodoro e é um excelente adesivo. Uma forma especial
que tem sido desenvolvida é tão adesiva que é virtualmente impossível para
remover a partir da superfície que está em contato. Isto leva a ataques
estratégicos sobre bases inimigas ou aeroportos, o VX permanece preso à área
e tem o potencial de matar qualquer um que tente se utilizar da base ou
aeroporto.
Projeto de arma com o gás VX
O "V" de VX
significa longa persistência. Por isso, é mais perigosa e tóxica do que seus
primos da variedade "G" como GA (Tabun) e GB (Sarin), que dissipam
rapidamente e têm apenas efeitos de curto prazo. Na forma líquida do VX, que
é absorvida através dos olhos ou a pele da vítima. Ele toma uma ou duas
horas para entrar em vigor e os seus efeitos resultam em morte. A forma
gasosa, é mais mortífera do que a forma líquida e atua quase imediatamente
na vítima. Os efeitos são piores quando ela é inalada e a morte é um fim ao
sofrimento.
Somente um pouco de DL50 como 10mg para o ser humano. Ele atua
cortando o sistema nervoso. Liga-se a enzima que transmite sinais para os
nervos e os inibe. Portanto os nervos tornam-se isolados e incontroláveis. O
antídoto, atropina, é uma toxina, mas isso contraria o efeito do VX, o
removendo da da enzima. É um agente anti-nervo o mesmo acontece com o
inverso do VX, um agente do nervo. Normalmente é injetado no braço ou na
coxa, mas para ataques gasosos a atropina deve ir imediatamente para o
coração. Então uma proteção corporal completa e máscaras de gás são
essenciais para evitar a exposição em um ataque de míssil VX.
O potencial completo do VX aninda não foi utilizado, pois é muito perigoso
para usar em ataques locais com vento que pode explodir o VX de volta para a
base. Este fator tem ajudado para que o VX não seja usado para mutilar
nações. Se estas armas forem lançadas contra uma nação, haveria a
possibilidade de um contra-ataque nuclear VX, porque é uma arma de
destruição em massa que se espalha a partir do ponto de impacto matando
todos em seu caminho. Esta seria contra atacada por outro, que em muitos dos
casos, seria uma bomba nuclear. Os únicos países conhecidos que possuem o VX
são E.U. França e Rússia. Inglaterra após tê-lo inventando abandonou o
pensamento de guerra termonuclear.
Efeito da Exposição do Gás VX em Halabja
A exposição
ao VX pode ser tratada. Tal como acontece com outros agentes nervosos, o
tratamento mais eficaz para VX é a injeção imediata da mistura das drogas
atropina e cloreto de pralidoxime, que neutralizam os efeitos do nervo
agente sobre o sistema nervoso periférico e ajuda as vítimas a respirarem, e
diazepam, o que contraria os efeitos do sistema nervoso central do VX,
incluindo apreensões. Os militares americanos estão equipados com kits
auto-injetores contendo os antídotos. Mas a droga deve ser administrada
imediatamente após a exposição ao VX. (Os antídotos podem ser perigosos para
aqueles que não foram expostos).
Às Vítimas, que inalam VX também deve ser dado acesso ao ar fresco. Aqueles
cuja pele teve contato com o VX devem tê-las lavadas com sabão e água. Outro
produto químico, brometo de piridostigmina, pode ser administrado antes da
exposição para aumentar a resistência ao VX.
Efeito da Exposição do Gás VX em Halabja
As pessoas
podem não saber que eles estão expostos instantaneamente ao VX.
Pessoas expostas a uma dose baixa ou moderada de VX por inalação, ingestão
(engolir), ou absorção cutânea pode enfrentar alguns ou todos os seguintes
sintomas dentro de segundos a horas de exposição: corrimento nasal,
lacrimejamento, pequenos pontos na pupila, dor ocular, visão turva
sialorréia e sudorese excessiva, tosse, aperto torácico, respiração rápida,
diarréia, aumento da frequência urinária, confusão, sonolência, fraqueza,
dores de cabeça, náuseas, vômitos e / ou dor abdominal, ritmo cardíaco lento
ou rápido, pressão arterial elevada ou baixa anormais.
Mesmo uma pequena gota de nervo agente sobre a pele pode causar sudorese e
contração espasmódica muscular quando o agente toca a pele.
A exposição a uma grande dose de VX por qualquer rota pode resultar nestes
efeitos sobre a saúde: perda de consciência, convulsões, paralisia,
insuficiência respiratória levando à morte.
Como o VX se compara ao gás sarin ou de gás mostarda?
Como o VX e o sarin são ambos agentes nervosos, têm efeitos semelhantes no
corpo. Mas VX é cerca de 100 vezes mais letal do que o sarin quando
absorvidos através da pele e cerca de 2000 vezes mais mortal quando
inalado. Além disso, sarin é volátil, evapora mais ou menos na mesma taxa da
água, e é mortífero quando inalado, enquanto VX é à base de petróleo,
extremamente adesiva, e duradouro. O gás mostarda, que não é menos letal que
osarin e o VX, mas pode levar aos mais duradouros efeitos para a saúde, como
câncer e defeitos congênitos.
Efeito da Exposição do Gás VX em Halabja
Testes
Norte-Americanos do VX
Na sequência da desclassificação de documentos secretos dos E.U.A de outubro
de 2002, surgiu a sugestão de que tropas das Forças Armadas Canadense "15º
Batalhão de Artilharia fossem cobaias nos testes de guerra química na"
Operação Elk Hunt " durante os anos 60. Documentos indicam que tropas
canadenses a partir do dia 15, bem como de outras unidades militares, foram
expostas ao gás de nervos VX, no Campo de Teste do Rio Gerstle (GRTS), perto
de Fort Greely, no Alasca...
"Elk Hunt" Fase 1 e 2 foram conduzidos simultaneamente perto de Fort Greely
durante 1964 e 1965. "Operação Elk Hunt" Fase 1 foi concebida para
determinar a quantidade de agentes nervos VX coletada do vestuário do
pessoal percorrendo diversos tipos de terrenos contaminados. VX foi
divulgado a partir de minas subterrâneas M23 detonadas em três tipos de
terreno e dentro d'água. "Operação Elk Hunt" Fase 2 foi semelhante mas
acrescentou veículos percorrendo o terreno contaminado. Foi reportado que os
canadenses conduziram 5 de 35 tentativas.
Este site foi atualizado em 04/03/19

 Às
17h do dia 22 de abril de 1915, durante a I Guerra Mundial,
as tropas alemãs na cidade de Ypres, na França,
descarregaram 180.000 kg de cloro gasoso contidos em
5.730 cilindros na região de Steenstraat no canal de
Yser e Poelcappelle. A nuvem de gás deslocou-se com o vento,
matando ou causando a fuga das tropas francesas e argelinas
nas trincheiras, abrindo uma abertura de 8 a 9 quilômetros
na linha aliada. Em 24 de abril de 1915, os alemães
realizaram um segundo ataque em Ypres, desta vez contra as
tropas canadenses.
Às
17h do dia 22 de abril de 1915, durante a I Guerra Mundial,
as tropas alemãs na cidade de Ypres, na França,
descarregaram 180.000 kg de cloro gasoso contidos em
5.730 cilindros na região de Steenstraat no canal de
Yser e Poelcappelle. A nuvem de gás deslocou-se com o vento,
matando ou causando a fuga das tropas francesas e argelinas
nas trincheiras, abrindo uma abertura de 8 a 9 quilômetros
na linha aliada. Em 24 de abril de 1915, os alemães
realizaram um segundo ataque em Ypres, desta vez contra as
tropas canadenses.