 |
Alguns chegam até a desmaiar só pelo simples fato de
olhar para ele.
Este fluido é essencial para a nossa sobrevivência e nos
reserva grandes surpresas. Alguém poderia imaginar que,
em algo inusitado estaria uma bela aula sobre
equilíbrio químico?
O
Portal de Estudos em Química
apresenta para vocês o equilíbrio ácido-base no Sangue! |
|
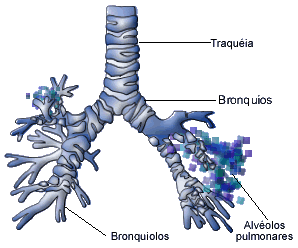
Composição do Ar Alveolar
O ar que
respiramos mistura-se com o gás já presente na
traquéia, brônquios e subdivisões mais
específicas das nossas vias aéreas pulmonares
sendo que uma parte desta mistura de gases é
levada aos alvéolos em expansão, onde ele entra
em contato com os capilares pulmonares que
transportam sangue venoso (rico em gás
carbônico).
 |
Pressão parcial
de um gás
A pressão parcial
de um gás é a pressão exercida pelo gás de forma
individual, não sofrendo interferência de
possíveis outros gases em um sistema. A pressão
parcial depende somente do número de mol de um
gás em um dado volume e temperatura. Por
exemplo:
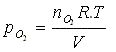
A pressão total
exercida por uma mistura gasosa como o ar
atmosférico, é a soma aritmética simples das
pressões parciais dos gases que formam a
mistura.
A pressão
barométrica (PB) é deste modo, a soma
das pressões parciais do oxigênio, dióxido de
carbono e nitrogênio do ar.

É importante dizer
que o conceito de pressão parcial é uma
idealização de um sistema. Não são consideradas
a interações entre os gases.
Difusão:
Processo espontâneo de transporte de massa num
sistema físico-químico, por efeito de gradientes
de concentração. |
 |
Em condições
de equilíbrio dinâmico, o fluxo de vai e vem do gás
dentro e fora dos espaços alveolares mantém a
constância da composição do ar alveolar. Em média, a
mesma quantidade de oxigênio acrescentada ao ar
alveolar é removida pelo sangue e a mesma quantidade
de dióxido de carbono transferida pelo sangue aos
alvéolos é lançada ao meio externo. Esse aspecto da
constância da composição do gás alveolar terá alguma
relação com o equilíbrio ácido-base em nosso sangue?
Em breve iremos responder essa pergunta.
Transporte de oxigênio no sangue
Quando a
pressão parcial do oxigênio é diferente em duas
partes de um sistema, estabelece-se um gradiente de
difusão, ou seja, o gás se difunde do local em que a
pressão parcial é maior para aquele em que ela é
menor. Caso o sistema permanecer sem perturbações, a
pressão parcial de um gás se torna a mesma em todas
as suas partes. |
O oxigênio difunde do ar
alveolar para o sangue porque o sangue venoso que flui pelos
pulmões tem uma Po2 (pressão parcial de gás oxigênio)
inferior à do ar alveolar.
A difusão
do oxigênio para o sangue venoso converte-o em sangue arterial.
O sangue passa rapidamente pelos pulmões com uma demora de 0,75
segundo, quando o homem está em um estado de repouso. Em uma
atividade física, em função da demanda de oxigênio, o tempo pode
cair para um valor de 0,3 segundos, visto que as funções
metabólicas como um todo trabalham em um ritmo acelerado,
necessitando por conseqüência de uma demanda maior de gás
oxigênio para realizar suas reações.
|
A membrana
alveolar é uma barreira à difusão do oxigênio e, por
isso, o oxigênio do sangue que passa através dos pulmões
não chega a atingir o equilíbrio completo com o ar
alveolar.
O oxigênio contido
no sangue arterial é transportado de duas maneiras: como
oxigênio dissolvido em solução física e na forma
conjugada com a
hemoglobina
presentes nos eritrócitos (glóbulos vermelhos). A
quantidade de oxigênio dissolvida e a quantidade
combinada com a hemoglobina dependem ambas do Po2
do sangue arterial. Este sangue arterial flui através de
tecidos em que a Po2 é inferior a do sangue.
Em alguns tecidos de grande fluxo sanguíneo, como o
cérebro por exemplo, a Po2 pode ser apenas
alguns milímetro de Hg inferior à arterial. Pelo fato da
Po2 dos tecidos ser inferior à do sangue
arterial, o oxigênio difunde-se do sangue para os
tecidos. A perda de oxigênio pelo sangue arterial,
juntamente do ganho simultâneo de dióxido de carbono,
converte o sangue arterial em venoso. O sangue venoso é
coletado pelas veias, misturando-se no ventrículo
direito e novamente circulando pelos pulmões. |

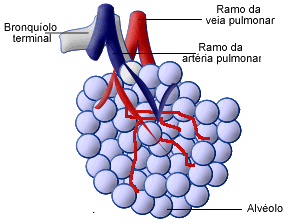
Cada
alvéolo tem um diâmetro cerca de 0,2mm. As paredes
alveolares são muito finas e no meio delas está uma
densa rede de capilares, que forma quase um lençol
contínuo de sangue, numa camada muito fina. |

Hemoglobina |
Um transportador de O2
é necessário no sangue porque O2 não é
suficiente solúvel no plasma sanguíneo para atender
às necessidades do corpo. Veja que, à 38°C, 1L de
plasma dissolve apenas 2,3 mL de O2. O
sangue total, em virtude de sua hemoglobina, tem uma
capacidade muito maior de transporte do oxigênio. Um
litro de sangue normalmente contém cerca de 150g de
hemoglobina (contida dentro dos eritrócitos) e cada
grama de hemoglobina é capaz de combinar-se
aproximadamente 1,46 mL de O2. Portanto,
a hemoglobina de 1L de sangue é capaz de transportar
220 mL de O2, cerca de
87 vezes mais
rápido para fornecer a mesma quantidade de O2.
Perceba que um fluxo 87 vezes mais rápido de sangue,
caso não existisse a hemoglobina, exigiria uma bomba
fabulosa de alta pressão, a qual produziria um fluxo
tremendamente turbulento, o que resultaria em
sangramento descontrolado após ferimentos e não
deixaria o sangue nos pulmões tempo suficiente para
captar o O2. Já imaginou você se cortar
com um fluxo de sangue 87 vezes mais rápido? |
|
A hemoglobina
nada mais é do que uma
proteína
que carrega consigo complexos inorgânicos tendo como
átomo central um íon de Ferro, complexo esse
denominado "Heme"
(veja figura ao lado). Diferentemente da mioglobina,
que também exerce papel no transporte de oxigênio e
possui apenas um grupo 'heme', a hemoglobina possui
quatro grupos 'heme'. Este complexo "heme" irá ser
responsável pela fixação e transporte do oxigênio,
uma vez que o complexo está ligado a estrutura
protéica da hemoglobina e esta, por sua vez, promove
o transporte de toda a estrutura. Cada hemoglobina
carrega 4 moléculas de gás oxigênio por vez, visto
que existem 4 complexos "heme" ligados a
hemoglobina. A ligação do complexo "heme" com o
oxigênio é
fraca e
instável,
dependendo de uma série de fatores, como
pH,
temperatura e da pressão parcial dos gases
dissolvidos no sangue. Portanto, o equilíbrio
ácido-base é um dos fatores fundamentais para que o
processo de transporte do oxigênio seja efetuado de
maneira satisfatória. |

Complexo Heme |
O equilíbrio
ácido-base em nosso organismo.
|
Há um fluxo
diário muito intenso de oxigênio, dióxido de carbono
e íon hidrogênio por todo o nosso corpo. O
metabolismo gera CO2, que se dissolve em
H2O para formar o ácido carbônico H2CO3
que, por sua vez, dissocia-se formando o íon
hidrogênio H+. Apesar das grandes
variações na produção de CO2, durante uma
atividade física por exemplo, o pH sanguíneo é
praticamente o mesmo:
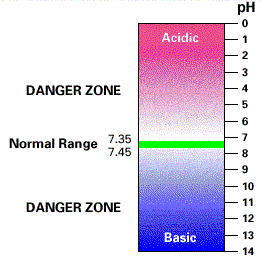
a concentração
de íons hidrogênio no plasma permanece na faixa
nanomolar (36-43 nmol.L-1; pH 7,37 -
7,44).
 |
Basicamente, a manutenção do equilíbrio
ácido - base envolve os pulmões, os
eritrócitos e os rins. Os pulmões, como
vimos no capítulo anterior, controlam as
trocas de dióxido de carbono e oxigênio
entre o sangue e a atmosfera externa. Os
eritrócitos, por sua vez, transportam os
gases entre os pulmões e tecidos de nosso
corpo. Os rins controlam a concentração de
bicarbonato, o qual possui ação de
tamponamento, excretando os íons hidrogênio
e regulam a produção de eritrócitos através
da secreção da eritropoetina, um hormônio
que estimula a síntese de eritrócitos. |
|
Em nosso organismo, a
atividade dos íons H+ varia de 0,13, no
suco gástrico mais ácido, a cerca de 0,00000003 no
suco pancreático mais alcalino. Afim de uma
representação prática dessas concentrações,
utilizou-se a o logaritmo negativo de base 10 da
atividade hidrogeniônica da solução. Este termo é
chamado de pH e sua definição matemática é:
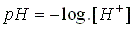
Na prática, a
atividade dos íons hidrogênio em uma solução é
medida eletrometricamente. Se a solução desconhecida
é separada de uma solução padrão, que possua sua
atividade hidrogeniônica conhecida, por uma membrana
permeável unicamente aos íons hidrogênio, o
potencial elétrico E da membrana é dado pela
equação:

onde R é a constante
dos gases, T é a temperatura absoluta, n é a
valência (que no caso é um) e F é a Constante de
Faraday. |
|
O efeito
tampão
Em linhas gerais,
a definição de uma solução tampão seria aquela que
é capaz de
atenuar a variação do valor de seu pH, resistindo à
adição, dentro de limites, de reagentes ácidos ou
alcalinos. Ao
mencionarmos os conceitos de "ácido e base", estamos
nos referindo a
definição de Brönsted-Lowry
(1923), a qual diz que
"ácido é uma
substância que libera prótons (um doador de prótons) e
uma base é uma substância que se combina com os prótons
(um receptor de prótons)".
Vamos pegar o
exemplo do ácido carboxílico, representado pela fórmula
geral R-COOH. Quando o ácido é dissolvido em água, o
grupo -OH dissocia-se para formar um íon hidrogênio e um
ânion, uma reação de equilíbrio que pode ser
representada conforme a reação abaixo:

O ânion da reação
é chamado de
base
conjugada,
devido sua propriedade de absorver um próton produzido
na reação. Se adicionarmos íons hidrogênio a uma solução
contendo um ácido e sua base conjugada, o aumento na
concentração hidrogeniônica
desloca para
a esquerda o equilíbrio.
Alguns íons hidrogênio se combinam com a base conjugada
para formar o ácido e, deste modo, alguns íons
hidrogênio desaparecem da solução. A concentração
hidrogeniônica final, após a adição do ácido, é menor do
que ela seria se a base conjugada não estivesse
presente. Por outro lado, uma redução de íons H+
da solução deslocaria o sentido da reação apara a
direita, e algumas das moléculas de ácido liberariam
íons hidrogênio.
Portanto, a ação
promovida pelo ácido e sua base conjugada tende a
reduzir as
modificações na concentração hidrogeniônica
de uma solução, formando por
isso, um sistema denominado "tampão" ou buffer. |
 |
O Francês
Henry Louis Le
Chatelier
que além de químico era também engenheiro
metalúrgico, nasceu em 1850 e faleceu em 1936.
Durante seus estudos sobre o andamento das
reações químicas, |
ele percebeu que era
possível prever o sentido de deslocamento dos
equilíbrios químicos, criando então a afirmativa que
hoje é conhecida como lei ou princípio de Le Chatelier.
"Quanto
um sistema em equilíbrio químico é perturbado por uma
ação externa, o próprio sistema tende a contrariar a
ação que o perturbou, afim de restabelecer a situação de
equilíbrio".
Uma experiência
interessante para demonstrar o deslocamento de
equilíbrio é aquela onde se produz, em função da
variação da pressão do sistema, o deslocamento do
equilíbrio da seguinte reação:
N2O4(g)
Û
2NO2(g)
Em um estado inicial
de equilíbrio, temos pouco NO2 (vermelho) e
muito N2O2 (incolor) e, portanto,
o sistema tem uma cor levemente avermelhada. Com a
diminuição da pressão (por exemplo, um aumento do
volume), ocorre a um deslocamento no equilíbrio do
sistema de forma que passamos a ter mais NO2
(vermelho) e menos N2O4 (incolor)
fazendo com que se veja a variação de um vermelho claro
para um vermelho mais intenso. |
Sistemas de
tamponamento no organismo
|
A hemoglobina exerce um papel importante
no tamponamento dos íons hidrogênio derivados da
reação da anidrase carbônica. Os ácidos gerados
durante o metabolismo e o íon hidrogênio gerado pela
fixação do CO2 são também tamponados por
tampões intracelulares, especialmente proteínas e
fosfatos. Contudo, o
bicarbonato é o
principal tampão
que neutraliza os ácidos provenientes do metabolismo
e será alvo de nosso estudo neste artigo. Na tabela
ao lado, há um resumo dos tampões existentes em
nosso organismo. |
Os tampões no organismo humano |
|
Tampões |
ácidos
|
bases conjugadas |
Principal ação de
tamponamento |
|
hemoglobina |
HHb |
Hb- |
eritrócitos |
|
proteínas |
HProt |
Prot- |
intracelular |
|
tampão fosfato |
H2PO4- |
HPO42- |
intracelular |
|
bicarbonato |
CO2®H2CO3 |
HCO3- |
extracelular |
Ação Tampão do
bicarbonato no sangue
Primeiramente, vamos
analisar a equação de
Henderson-Hasselbach
para o cálculo do pH de uma solução tampão.
 (5) (5)
para quem quiser conferir a dedução
da fórmula
de Henderson-Hasselbach,
clique aqui
Quando a base e o ácido
conjugados estão presentes em igual concentração, sua razão é de
1, e o log é 0, de modo que pH = pKa. Os tampões são
soluções que minimizam uma alteração de [H+] mediante
a adição de ácido ou de base. Um tampão possui uma capacidade de
tamponamento máxima em seu pKa quando as formas
ácidas e básicas estão presentes em igual concentração.
|
Este sistema
de tamponamento do bicarbonato é singular, pois ele
permanece em equilíbrio com o ar atmosférico,
criando, dessa forma, um sistema aberto com uma
capacidade de tamponamento muitas vezes maior do que
aquela dos sistemas "fechados".
O dióxido de
carbono produzido nos tecidos se difunde através das
membranas celulares e dissolve-se no plasma
sanguíneo. O coeficiente de solubilidade do CO2
em água é de 0,23 quando a pCO2 é medida
em kPa (ou 0,03 se medida em mmHg). Assim, com uma
pCO2
de 5,3kPa, a concentração de CO2,
dissolvido (dCO2) é de:
|
Unidades de pressão
A pressão pode
ser expressa em diversas unidades de medida. Abaixo,
relacionamos as conversões entre essas unidades.
|
Grandeza |
Nome |
Símbolo |
Equivalência |
|
pressão |
atmosfera |
atm |
101 325 Pa |
|
pressão |
bar |
bar |
105 Pa |
|
pressão |
milímetro
de mercúrio |
mmHg |
133,322 Pa |
|
dCO2
(mmol/L) = 5,3kPa x 0,23 = 1,2 mmol/L
|
Normalmente,
existem aproximadamente 24mmol/L de bicarbonato no
plasma. O pK do tampão bicarbonato é de 6,1 e se
inserirmos as concentrações dos componentes do
tampão na equação anterior, veremos que:

O tampão
bicarbonato minimiza as modificações na concentração
de íons hidrogênio com a adição de um ácido ou de
uma base no plasma. Quando o ácido é adicionado, o
bicarbonato reage e o CO2 é liberado:
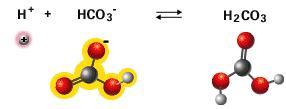
O ácido
carbônico é uma estrutura muito instável e logo se
dissocia em dióxido de carbono e água. O excesso de
CO2 é então eliminado pelos pulmões. Já
quando uma base é adicionada, o ácido carbônico/CO2
neutraliza a base em água: |
Em
primeiro lugar, o componente que consideramos como
ácido nesse sistema tampão é CO2, que é
um anidrido ácido, não um ácido. Reage com a água
para formar ácido carbônico, o qual sabemos que é um
ácido fraco:
CO2 + H2O
Û
H2CO3
(1)
O
ácido rapidamente ioniza-se em:
H2CO3
Û
H+ + HCO3-
(2)
Somando as equações 1 e 2, temos:
CO2 + H2O
Û
H+ + HCO3-
(3)
A
eliminação de H2CO3 de
concentração formal é realístico, uma vez que não
apenas simplifica o assunto, mas o H2CO3
é, de fato, quantitativamente insignificante. Como o
equilíbrio da reação (1) é muito deslocado para a
esquerda,
H2CO3
está presente apenas 1/200 da concentração de
CO2
dissolvido. |
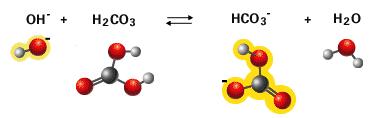
É importante ressaltar que
a solução tampão tem um determinado limite de ação. Ultrapassado
esse limite, a variação de pH ocorre como se não existisse mais
um sistema tampão. Nestes casos, ocorrem patologias relacionadas
com distúrbios ácido-base, os quais iremos ver a seguir.
Os distúrbios ácido-base
metabólicos e respiratórios
Os pulmões e os rins
trabalham de maneira integrada para minimizar as alterações de
pH plasmático e podem compensar um ao outro na presença de
perturbações. Os distúrbios de equilíbrio ácido-base podem ter
sua origem
metabólica, respiratória ou mista.
Quando um problema ocorre em um dos componentes, o outro busca
compensar minimizando as alterações finais nas concentrações
plasmáticas de íons hidrogênio.
Quando a concentração de
íons H+ no sangue é elevada, temos uma diminuição do
pH o que chamamos de
acidose,
a qual é geralmente classificada como metabólica ou
respiratória, classificação esta que dependerá da origem que
promoveu o desequilíbrio. Já a
alcalose
é o distúrbio inverso, ou seja, há um aumento do pH sanguíneo em
virtude da diminuição de íons H+ no sangue,
considerado um distúrbio raro em relação ao da acidose. Esses
dois distúrbios podem levar, caso não haja providência
imediatas, o indivíduo a morte devido ao colapso metabólico que
é produzido.
29/05/2003
Química: Hidróxido de lítio salva astronautas
LUÍS FERNANDO PEREIRA
da Folha de S.Paulo
"Houston, we have a problem". Ao enviar essa
mensagem em 13 de abril de 1970, o comandante da
missão espacial Apollo 13, Jim Lovell, sabia: a sua
vida e as dos seus dois companheiros estavam por um
fio. Um dos tanques de oxigênio (O2) da
nave tinha acabado de explodir.
Apesar do perigo iminente de os astronautas ficarem
sem O2 para respirar, a principal
preocupação da Nasa era evitar que a atmosfera da
espaçonave ficasse saturada do gás carbônico (CO2)
exalado pela própria equipe.
Isso causaria um abaixamento do pH do sangue
da tripulação (acidemia sanguínea), já que o CO2
é um óxido ácido (em água ele forma ácido carbônico:
CO2 + H20 --> H2CO3)
como, aliás, a grande maioria dos óxidos ametálicos
(o carbono é um ametal).
A acidemia sanguínea deveria ser evitada a qualquer
custo. Inicialmente, ela leva a pessoa a ficar
desorientada e a desmaiar, podendo evoluir até o
coma ou mesmo a morte.
Normalmente, a presença de CO2 na
atmosfera da nave não é problema. Para eliminá-lo,
há, adaptados à ventilação, recipientes com
hidróxido de lítio (LiOH), uma base capaz de
absorver esse gás. Nada quimicamente mais sensato:
remover um óxido ácido da atmosfera da nave lançando
mão de uma base: CO2 + 2LiOH
®
Li2CO3 + H2O.
O problema é que os três astronautas tiveram de se
refugiar numa parte da espaçonave chamada módulo
lunar: pequena e preparada para duas pessoas. Depois
de um dia e meio, uma luz de alerta acendeu: o CO2
havia atingido um nível muito alto. Sinal de que a
quantidade de LiOH, calculada para dois astronautas,
não estava dando conta do recado.
Um improviso de última hora com o hidróxido de lítio
do módulo de comando (outra área da espaçonave)
salvou a vida de toda a tripulação.
E se existissem substâncias que, além de absorverem
o CO2, ao mesmo tempo restaurassem o O2?
Seria ótimo! E essas substâncias existem. São os
superóxidos! O superóxido de potássio (K2O4)
já vem sendo utilizado em submarinos. Veja só o que
ele faz:
K2O4 + CO2
®
K2CO3 + 3/2O2.
No espaço e até no fundo do mar. Tem química em todo
lugar!
Depois da leitura, responda a questão que
encontra-se na coluna ao lado sobre a solução
sugerida.
---
Reprodução do texto gentilmente cedida pelo autor
Leia o original através do site
http://www1.folha.uol.com.br/folha/educacao/ult305u12947.shtml |

Que massa desse superóxido é necessária para remover
todo o CO2 exalado por um tripulante
durante quatro dias de viagem nesse submarino (uma
pessoa exala, em média, 1,1 kg de CO2 por
dia)? |
Agora é a sua vez!
Abaixo, seguem duas
questões sobre o equilíbrio químico do sangue com o objetivo de
demonstrar a importância desse assunto bem como evidenciar a
maravilha que é a nossa vida. Ah!, as perguntas também têm como
objetivo fazer com que
você não fique ai 'sentadão',
esperando tudo pronto ou, como popularmente se comenta:
'de mão beijada'.
Pensou que era só ler né?
Vamos trabalhar!
:)
|
Questão
1 |
Questão
2 |
|
Para um sistema estar em
equilíbrio, geralmente é de se esperar que esse
sistema seja do tipo "fechado" visto que, dessa
forma, não há variação na quantidade de reagentes e
produtos além da possibilidade de um melhor controle
perante as variáveis de estado deste sistema.
Apesar de nós sermos um "sistema aberto",
no que diz respeito ao equilíbrio ácido-base de
nosso sangue, ocorre uma incrível constância
no valor de pH, evidenciando uma notável
condição de equilíbrio químico. Com base na leitura
do texto e utilizando-se também de outras fontes
sobre o assunto, explique os motivos que permitem
que esse fenômeno aconteça. |
Quando você vai viajar para uma cidade de
grande altitude (como por exemplo, La Paz, com 3.636
metros de altitude) são comuns alguns desconfortos
físicos. Em casos extremos, certas pessoas podem até
morrer caso não recebam tratamento em tempo.
Existe um equilíbrio entre a
hemoglobina e a oxi-hemoglobina
(hemoblogina + O2) e este equilíbrio é
que será responsável pelos efeitos indesejados
mencionados no parágrafo anterior. Explique como
ocorre esse deslocamento de equilibro,
tanto para a pessoa que recém chegou na cidade e
está sentindo os efeitos da altitude bem como para
aquela pessoa que se habituou ao clima.
|
Bibliografia
Utilizada
 Mazzocchin, Gian-Antônio; Moretto,
Ligia M. "Ácidos e Bases: uso de diagramas logarítmicos".
Caxias do Sul: EDUC, 1996.
Mazzocchin, Gian-Antônio; Moretto,
Ligia M. "Ácidos e Bases: uso de diagramas logarítmicos".
Caxias do Sul: EDUC, 1996.
 Dovenport,
Horace W; "ABC da Química Ácido-Básica do Sangue".
Traduzida da 5ª edição revista e ampliada por José Reinaldo
Magalhães. São Paulo: Editora Atheneu, 1973. Dovenport,
Horace W; "ABC da Química Ácido-Básica do Sangue".
Traduzida da 5ª edição revista e ampliada por José Reinaldo
Magalhães. São Paulo: Editora Atheneu, 1973.
 Baynes,
John, Dominiczak, Marek H. "Bioquímica Médica".1ª edição
brasileira. São Paulo: Editora Manole, 2000. Baynes,
John, Dominiczak, Marek H. "Bioquímica Médica".1ª edição
brasileira. São Paulo: Editora Manole, 2000.
 Thomas,
M. Delvin. "Manual de Bioquímica com Correlações Clínicas".
Tradução da 4ª edição Americana. São Paulo: Editora Edgard
Blücher Ltda, 2002. Thomas,
M. Delvin. "Manual de Bioquímica com Correlações Clínicas".
Tradução da 4ª edição Americana. São Paulo: Editora Edgard
Blücher Ltda, 2002.
 Parson,
Theran D.; Slabaugh, Wendell H.; "Química Geral". 2ª
edição. Rio de Janeiro. Editora LTC, 1982. Parson,
Theran D.; Slabaugh, Wendell H.; "Química Geral". 2ª
edição. Rio de Janeiro. Editora LTC, 1982.
 Koolman,
Jan; Röhm, Klaus-Heinrich. "Color Atlas of Biochemistry"
- New York: Editora Thieme Stuttgart, 1996. Koolman,
Jan; Röhm, Klaus-Heinrich. "Color Atlas of Biochemistry"
- New York: Editora Thieme Stuttgart, 1996.
 Washington University Department of Chemistry - Blood Chemistry
Tutorial
Washington University Department of Chemistry - Blood Chemistry
Tutorial
http://www.chemistry.wustl.edu/~edudev/LabTutorials/blood.htm
 Portal de
Estudos em Química - Solução
Tampão Portal de
Estudos em Química - Solução
Tampão
 Ática
Educacional - Sistema Circulatório (animação em flash) Ática
Educacional - Sistema Circulatório (animação em flash)
http://www.aticaeducacional.com.br/htdocs/atividades/sist_circ/index.htm
 Ática
Educacional - Sistema Respiratório (animação em flash) Ática
Educacional - Sistema Respiratório (animação em flash)
http://www.aticaeducacional.com.br/htdocs/atividades/sist_resp/index.htm
|