|
SUPER-HERÓIS SINTÉTICOS
vs. SUPERBUGS
 O
grande vilão da humanidade bem poderia ser alguém como o grandalhão
Godzilla ou,
quem sabe, algum alienígena
remanescente do filme Men in Black.
Porém, para a medicina, o supervilão que ameaça a humanidade é muito
menor que o ponto no final desta linha.
São formas de vida minúsculas que, nos
últimos anos, estão ficando cada vez mais poderosas e resitentes a
tudo o que a medicina tem para oferecer. O
grande vilão da humanidade bem poderia ser alguém como o grandalhão
Godzilla ou,
quem sabe, algum alienígena
remanescente do filme Men in Black.
Porém, para a medicina, o supervilão que ameaça a humanidade é muito
menor que o ponto no final desta linha.
São formas de vida minúsculas que, nos
últimos anos, estão ficando cada vez mais poderosas e resitentes a
tudo o que a medicina tem para oferecer.
Os
vilãos que realmente ameaçam nossa sobrevivência são as inúmeras
espécies de bactérias microscópicas que cohabitam não somente
nossa vizinhança, mas também nossos corpos. Na maioria dos casos, as
bactérias são inofensivas e, algumas vezes, até mesmo benéficas.
Mas, as vezes, especialmente quando o sistema imunológico de nosso
organismo está debilitado, as bactérias podem crescer e se
multiplicar, saindo de controle, e causar uma infecção. A
maioria de nós, então, sabe exatamente o que fazer: tomar um
antibiótico! Certo?... Bem, nem tanto. Ninguém pode duvidar do
 poder
e benefício trazido pelos antibióticos, desde que eles vieram ao
mercado, em 1940. Mas os médicos alertam: as bactérias estão se
tornando resistentes aos antibióticos conhecidos. Nos hospitais,
uma variação do Staphylococcus (MRSA) ronda os
corredores e salas cirúrgicas. Esta bactéria é imunde a praticamente
todos os antibióticos disponíveis! Como escapar, então, destes novos
"SuperBugs?". Os médicos descobriram que podiam, ainda,
vencer estas bactérias com uma droga chamada vancomicina. Mas
algumas internações hospitalares chamaram a atenção: poder
e benefício trazido pelos antibióticos, desde que eles vieram ao
mercado, em 1940. Mas os médicos alertam: as bactérias estão se
tornando resistentes aos antibióticos conhecidos. Nos hospitais,
uma variação do Staphylococcus (MRSA) ronda os
corredores e salas cirúrgicas. Esta bactéria é imunde a praticamente
todos os antibióticos disponíveis! Como escapar, então, destes novos
"SuperBugs?". Os médicos descobriram que podiam, ainda,
vencer estas bactérias com uma droga chamada vancomicina. Mas
algumas internações hospitalares chamaram a atenção:
Em 1997, ocorreram 3 infecções (uma no Japão e duas nos EUA) de MRSA
que eram resistentes mesmo a vancomicina. Estas bactérias eram, na
verdade, resistentes aos mais de 100 tipos de antibióticos testados.
Está na hora dos SUPERQUÍMICOS entrarem em ação!

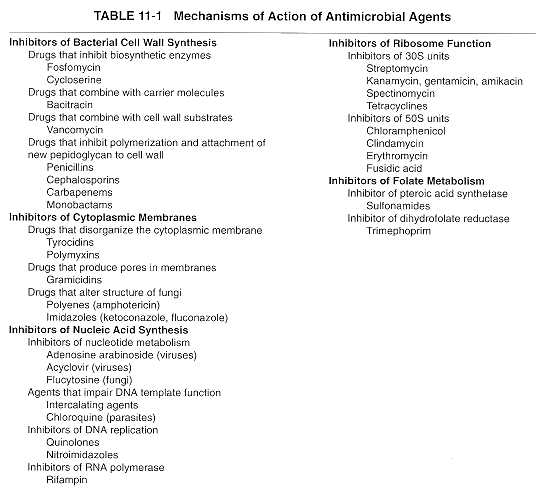
Mecanismo de ação dos antibióticos I

Mecanismo de ação dos antibióticos II
a–f
depict metabolic pathways in the cell that have
been, or are proposed to be, targets for
antibiotic action. a |
Cell-wall biosynthesis: the intracellular steps
of murein (peptidoglycan) biosynthesis are
catalysed by the enzymes MurA–F and MurG
(steps1–4). Peptidoglycan is a polymer of two
hexoses (filled hexagons) — N-acetylglucosamine
(GlcNac) and N-acetyl-muramic
acid (MurNAc). Peptidoglycan units are
transferred to a carrier lipid —
bactoprenol-phosphate (orange circles) — which
transports precursor molecules across the cell
membrane, generating Lipids I and II. Sugars and
phosphates are added by transglycosylation and
pyrophosphorylation (steps 5 and 6), and finally,
a peptide bond between the peptide chains is
formed (step 7). Antibiotics that inhibit
cell-wall synthesis are indicated.
b | Protein biosynthesis:
bacterial ribosomes comprise two subunits (30S
and 50S) of rRNA and protein. Structural studies
have identified the sites at which antibiotics
bind. c | DNA and RNA
replication: rifampin binds to RNA polymerase
and prevents attachment of the polymerase to
DNA, thereby inhibiting transcription.
Ciprofloxacin and novobiocin bind to DNA gyrase,
thereby preventing the introduction of
supercoils in DNA. d |
Folate metabolism: folate is necessary for the
synthesis of thymine, which, in turn, is an
essential component of DNA. The figure shows
antibiotics that block steps in folate
metabolism and therefore block the synthesis of
thymine. e | Cell-surface
decoration: during cell-wall synthesis in
Gram-positive bacteria, surface proteins are
cleaved by sortases — enzymes that are anchored
in the membrane by an amino-terminal
membrane-spanning sequence. Sortases covalently
attach the amino-terminal cleavage fragment of
the surface protein to the peptidoglycan (PG)
layer of the cell wall. f
| Isoprenoid biosynthesis: the enzymes of the
non-classical isoprenoid pathway in bacteria are
not present in higher organisms, and should
therefore be good antibacterial targets. dTMP,
thymidylate; dUMP, deoxyuridine monophosphate;
DXR, 1-deoxy-D-xylulose
5-phosphate (DX) reductoisomerase; DXS, DX
synthase; GcpE, 1-hydroxy-2-methyl-2-(E)-butenyl
4-diphosphate synthase; GTP, guanosine
triphosphate; LytB, Isoprenoid H protein; YchB,
4-diphospho-2C-2-methyl-D-erythritol
kinase; YgbB, 2C-methyl-D-erythritol
2,4-cyclodiphosphate synthase; YgbP, 4-diphosphocytidyl-2C-methylerythritol
synthase.
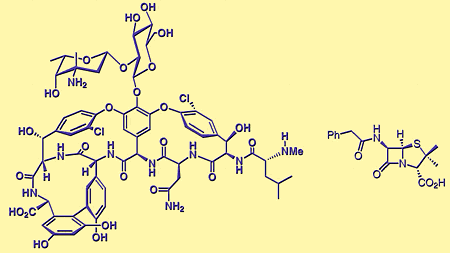
vancomicina e
penicilina
Um
químico sabe que o mecanismo de ação das drogas e as maneiras de
melhorar seus efeitos jazem em sua estrutura química. A
estrutura da vancomicina é complexa e tem intrigado os químicos
desde a sua elucidação, em 1977. A droga é constituida por um
esqueleto de 7 amino ácidos (os tijolos das proteínas)
inteligados por cadeias laterais. No topo da molécula estão dois
acúcares parentes da glucose.
|
Sabão
com bactericida (Protex) - diga não! |
Sabonetes com antibióticos podem contribuir para aumentar a
resistência das bactérias - é o que disseram
 McMurry
e Levy, pesquisadores da Tufts University Medical
School em Boston, em um artigo da revista Nature
(Aug 6 1998). Sua pesquisa mostrou que o triclosan,
um dos principais antibióticos usados em sabonetes
bactericidas (vide estrutura), contribui para o crescimento
do colônias resistentes. Seus resultados mostram que
triclosan tem um sítio de ação definido e que bactérias
mutantes podem aparecer. McMurry
e Levy, pesquisadores da Tufts University Medical
School em Boston, em um artigo da revista Nature
(Aug 6 1998). Sua pesquisa mostrou que o triclosan,
um dos principais antibióticos usados em sabonetes
bactericidas (vide estrutura), contribui para o crescimento
do colônias resistentes. Seus resultados mostram que
triclosan tem um sítio de ação definido e que bactérias
mutantes podem aparecer.
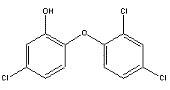
Isto auxilia no surgimento de bactérias imunes aos
antibióticos terapêuticos. "People think they are
sterilizing the world by using these products and, in fact,
they are potentially changing it,” disse Dr. Stuart Levy,
um dos autores. “They really are over-the-counter
antibiotics.”
Existem evidências fortes de que a população mundial vem
usando antibióticos desnecessariamente. Os órgãos de saúde
já vêm alertando sobre o problema há muito tempo.
|
Como
contém tanto aminoácidos (peptídeos) e acúcar a vancomicina é
classificada como um glicopeptídeo. A questão que intriga os
químicos é: como esta droga age no organismo? Um bom ponto de
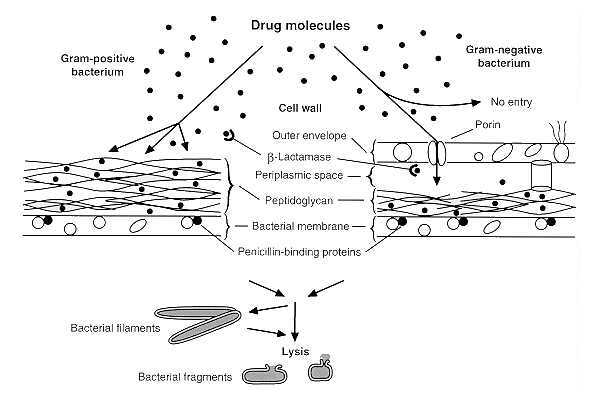
partida é saber que, para um antibiótico ser válido, deve interagir
somente com a parede celular da bactéria, e ser inerte às células
humanas. As paredes celulares de bactérias são formadas pelos mesmos
componentes que constituem a vancomicina: amino ácidos e açucares.
Entretanto, estas paredes tem uma arquitetura diferente: são os
acúcares que estão interligados em longas cadeias com amino ácidos
"pendurados". Além disso, os peptídeos de uma determinada cadeia
estão interligados com os peptídeos da cadeia vizinha. Desta forma,
as camadas de cadeias de açúcares estão ligadas entre si. Toda esta
"interconectividade" é que garante às paredes celulares de bactérias
uma propriedade especial: rigidez. Uma forte parede celular atua
como uma barreira entre a célula da bactéria e as vizinhanças
aquosas. Sem esta barreira, a célula iria absover muita água e a
bactéria acabaria morrendo. A vancomicina é, portanto, o "alfinete"
que estoura esta "bolha". A molécula pode se ligar, devido a sua
semelhança estrutural com os amino ácidos "pendurados", nas cadeias
de açúcares. A vancomicina reconhece dois amino ácidos presentes nos
peptídeos da bactéria - duas formas da alanina. O esqueleto da
vancomicina pode formar até 5 fortes pontes de hidrogênio com
os peptídeos.
Estas
cadeias, então, perdem a habilidade de se ligar a outras cadeias via
interligação peptídica. Isto é suficiente para tornar a parede
celular menos rígida e espalhar o desastre para as bactérias!
|
Bactérias Resistentes |
Uma bactéria pode adquirir resistência a um determinado
antibiótico por várias
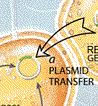 maneiras.
Tais como a mutação genética que, no caso das bactérias,
ocorre com muita frequência. Algumas vezes a mutação pode
levar, espontaneamente, a uma bactéria que resiste a droga
aplicada. As outras bactérias podem, também, adquirir esta
resitência através da troca de genes com as bactérias
resitentes. Na verdade, a troca de genes entre bactérias é
tão comum, que poderia se olhar a colônia de bactérias como
sendo um único organismo multicelular. maneiras.
Tais como a mutação genética que, no caso das bactérias,
ocorre com muita frequência. Algumas vezes a mutação pode
levar, espontaneamente, a uma bactéria que resiste a droga
aplicada. As outras bactérias podem, também, adquirir esta
resitência através da troca de genes com as bactérias
resitentes. Na verdade, a troca de genes entre bactérias é
tão comum, que poderia se olhar a colônia de bactérias como
sendo um único organismo multicelular.
Quando um antibiótico ataca um grupo de bactérias, as
células suscetíveis irão morrer. Algumas células,
entretanto, irão sobreviver e, na ausência de competidores,
irão se proliferar. Um nova colônia, então, é formada - de
bactérias resistentes. |
Bem,
isto é o que acontece com as bactérias "normais". A mágica inicia
quando se pensa sobre os "SUPERBUGS". Estas bactérias possuem, no
lugar dos grupos alanina-alanina, grupos alanina-lactato. A
vancomicina, portanto, não é capaz de ligar-se a este sítio, não
apresentando nenhum perigo para a bactéria.
Três químicos (Evans, Nicolau e Boger) chegaram, independentemente,
a uma série de reações que permitia se chegar a vancomicina (sem os
dois grupos açúcares) a partir dos materiais elementares (i.e.,
amino ácidos). Nicolaou publicou a síntese da molécula inteira.
Jonathan Ellman e seu grupo usaram as ferramentas da química
orgânica sintética para melhorar a vancomicina: utilizando uma
técnica chamada "Química Combinacional" eles encontraram qual seria
o grupo necessário na vancomicina para que esta interagisse com os
Superbugs. O resultado foi que cerca de 40.000 novos tipos de
vancomicina poderiam ser capazes de se ligar aos superbugs. O grupo
de Ellman, então, partiu para testes químicos: eles prepararam
cadeias com cada um dos análogos da nova droga. Em um frasco com
água, eles adicionaram todas as "vancomicinas" e também moléculas de
alanina-lactato, ligadas a uma sonda fluorescente. Somente alguns
protótipos de vancomicina apresentaram fluorescência, i.e.,
ligaram-se às moléculas alanina-lactato. Estes são exatamente as
vancomicinas capazes de derrotar o superbug! Seus resultados
ainda não chegaram ao mercado, mas indicam que há, sim, uma maneira
de combater os superbugs! Daniel Kahne da Princeton University diz
que "The scientis are progressing towards better and better drugs
that can hopefully keep infections at bay". Resumindo, talvez
novos superbugs apareçam, mas sempre haverá químicos que
podem lutar contra estes e salvar a humanidade da terrível
ameaça dos Supervilões.
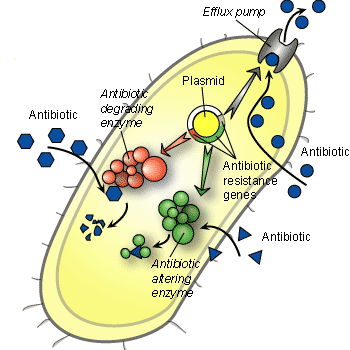
Mecanismo de ação de resistência aos antibióticos
Para Saber Mais
|
 O
grande vilão da humanidade bem poderia ser alguém como o grandalhão
Godzilla ou,
quem sabe, algum alienígena
remanescente do filme Men in Black.
Porém, para a medicina, o supervilão que ameaça a humanidade é muito
menor que o ponto no final desta linha.
São formas de vida minúsculas que, nos
últimos anos, estão ficando cada vez mais poderosas e resitentes a
tudo o que a medicina tem para oferecer.
O
grande vilão da humanidade bem poderia ser alguém como o grandalhão
Godzilla ou,
quem sabe, algum alienígena
remanescente do filme Men in Black.
Porém, para a medicina, o supervilão que ameaça a humanidade é muito
menor que o ponto no final desta linha.
São formas de vida minúsculas que, nos
últimos anos, estão ficando cada vez mais poderosas e resitentes a
tudo o que a medicina tem para oferecer. poder
e benefício trazido pelos antibióticos, desde que eles vieram ao
mercado, em 1940. Mas os médicos alertam: as bactérias estão se
tornando resistentes aos antibióticos conhecidos. Nos hospitais,
uma variação do Staphylococcus (MRSA) ronda os
corredores e salas cirúrgicas. Esta bactéria é imunde a praticamente
todos os antibióticos disponíveis! Como escapar, então, destes novos
"SuperBugs?". Os médicos descobriram que podiam, ainda,
vencer estas bactérias com uma droga chamada vancomicina. Mas
algumas internações hospitalares chamaram a atenção:
poder
e benefício trazido pelos antibióticos, desde que eles vieram ao
mercado, em 1940. Mas os médicos alertam: as bactérias estão se
tornando resistentes aos antibióticos conhecidos. Nos hospitais,
uma variação do Staphylococcus (MRSA) ronda os
corredores e salas cirúrgicas. Esta bactéria é imunde a praticamente
todos os antibióticos disponíveis! Como escapar, então, destes novos
"SuperBugs?". Os médicos descobriram que podiam, ainda,
vencer estas bactérias com uma droga chamada vancomicina. Mas
algumas internações hospitalares chamaram a atenção: 


 McMurry
e Levy, pesquisadores da Tufts University Medical
School em Boston, em um artigo da revista Nature
(Aug 6 1998). Sua pesquisa mostrou que o triclosan,
um dos principais antibióticos usados em sabonetes
bactericidas (vide estrutura), contribui para o crescimento
do colônias resistentes. Seus resultados mostram que
triclosan tem um sítio de ação definido e que bactérias
mutantes podem aparecer.
McMurry
e Levy, pesquisadores da Tufts University Medical
School em Boston, em um artigo da revista Nature
(Aug 6 1998). Sua pesquisa mostrou que o triclosan,
um dos principais antibióticos usados em sabonetes
bactericidas (vide estrutura), contribui para o crescimento
do colônias resistentes. Seus resultados mostram que
triclosan tem um sítio de ação definido e que bactérias
mutantes podem aparecer.

 maneiras.
Tais como a mutação genética que, no caso das bactérias,
ocorre com muita frequência. Algumas vezes a mutação pode
levar, espontaneamente, a uma bactéria que resiste a droga
aplicada. As outras bactérias podem, também, adquirir esta
resitência através da troca de genes com as bactérias
resitentes. Na verdade, a troca de genes entre bactérias é
tão comum, que poderia se olhar a colônia de bactérias como
sendo um único organismo multicelular.
maneiras.
Tais como a mutação genética que, no caso das bactérias,
ocorre com muita frequência. Algumas vezes a mutação pode
levar, espontaneamente, a uma bactéria que resiste a droga
aplicada. As outras bactérias podem, também, adquirir esta
resitência através da troca de genes com as bactérias
resitentes. Na verdade, a troca de genes entre bactérias é
tão comum, que poderia se olhar a colônia de bactérias como
sendo um único organismo multicelular.

