 Tem gente que, mesmo vivendo sob dieta, está
sempre gordo; outros, comem muito, mas nunca
engordam (dizem que são "magros de ruim").
A obesidade, entretanto, é um mal que
afeta grande parte da população e é diretamente
responsável por várias doenças fatais.
Tem gente que, mesmo vivendo sob dieta, está
sempre gordo; outros, comem muito, mas nunca
engordam (dizem que são "magros de ruim").
A obesidade, entretanto, é um mal que
afeta grande parte da população e é diretamente
responsável por várias doenças fatais.
Haveria uma causa
genética para a obesidade?
PEQ apresenta um artigo de 3
estudantes de pós graduação do departamento de
Bioquímica da UNICAMP: Daniele Araújo,
José Antônio da Silva, e Leonardo
Fernandes Fraceto, sobre a
"Leptina, o hormônio da
obesidade"
|
A leptina é um
hormônio protéico específico produzido e
secretado pelo tecido adiposo, que funciona como um
"adipostato", referindo-se à Teoria Lipostática, que
prediz que a composição e o peso corporais em
humanos são determinados por interações entre
fatores genéticos, ambientais, comportamentais e
sociais e da resposta a um sinal periférico
produzido em quantidades proporcionais ao tecido
adiposo no organismo.
A existência desse fator circulante, que
aumenta com os estoques de energia e age no cérebro
para inibir a ingestão de alimentos e as reservas no
tecido adiposo, foi descoberta após
mutações genéticas
(Figura 1) denominadas por obese (ob)
e diabetes (db). Baseado nesses estudos foi
sugerido que a mutação ob estava relacionada à
produção de um fator circulante e a db com a
resposta a esse mesmo fator. Assim, o fator
circulante, produto do gene ob, foi chamado
leptina (do grego leptos que
significa magro), porque este mostrou ser capaz de
diminuir o peso corporal e a massa de tecido adiposo
quando injetado em camundongos.
 Figura 1: Os dois camundongos
apresentam a mesma idade, sendo que o da
esquerda apresenta deficiência na
produção do hormônio leptina.
Figura 1: Os dois camundongos
apresentam a mesma idade, sendo que o da
esquerda apresenta deficiência na
produção do hormônio leptina.
|
A descoberta da leptina tem ajudado a esclarecer o
papel dos
adipócitos como sistema endócrino e de
que modo ocorre a sinalização para a ingestão ou não
de alimentos, bem como, a regulação do metabolismo
energético. Assim, a coordenação do balanço
energético e do peso corporal envolve uma regulação
entre a ingestão de alimentos e gasto de energia
em resposta a sinais agudos (insulina, catecolaminas
como a adrenalina) e rônicos (gravidez, desnutrição,
inflamações, caquexia e leptina).
A leptina é sintetizada como um peptídeo de 167
aminoácidos (aa), transportada para a circulação
sanguínea com apenas 146 aa e uma massa molecular de
14-16 kDa. A cristalografia revela quatro hélices
com estruturas semelhantes às das citoquinas, tais
como as interleucinas (Figura 2).
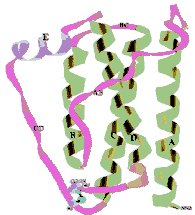
Figura 2:
A leptina
apresenta-se como um feixe de quatro
a-hélices (A a
D). |
SÍNTESE E
REGULAÇÃO
A leptina é
produzida principalmente no tecido adiposo,
embora também possa ser encontrada (em poucas
quantidades) no epitélio intestinal, placenta
(funcionando com um fator de crescimento para o
feto, por sinalizar o estado nutricional da mãe),
leite materno, músculo esquelético, gástrico e
cérebro.
É codificada por um gene que tem três exons
e dois íntrons (Figura 3). A região
promotora tem elementos como TATA box, C/EBP (região
de ligação à proteínas), GRE (elemento responsivo a
glicocorticóides) e CREB (elemento de ligação à
proteínas responsivo ao AMPc). A transcrição e a
tradução ocorrem no tecido adiposo, placenta e trato
gastrintestinal, onde a razão de produção é
diretamente relacionada à massa de tecido adiposo.
Em um indivíduo com peso corporal normal, a leptina
está mais correlacionada com a massa de gordura
absoluta do que com o índice de massa corpórea (BMI)
ou percentagem de gordura corporal.
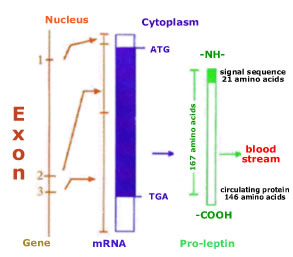 Figura 3: Síntese da leptina. O
gene da leptina consiste de três exons e
dois introns. O gene é transcrito por
RNAm que codifica um pró-hormônio de 167
aa. A sequência sinal contém 21 aa e é
removida para a liberação da leptina na
corrente sanguínea.
Figura 3: Síntese da leptina. O
gene da leptina consiste de três exons e
dois introns. O gene é transcrito por
RNAm que codifica um pró-hormônio de 167
aa. A sequência sinal contém 21 aa e é
removida para a liberação da leptina na
corrente sanguínea.
|
Os níveis de leptina circulantes parecem estar
diretamente relacionados com a quantidade de RNAm
para leptina no tecido adiposo. Além disso, vários
fatores metabólicos e endócrinos contribuem para
regular a transcrição dos genes da leptina em
adipócitos. Por exemplo, ocorre
diminuição de leptina
em resposta a baixos níveis de insulina,
havendo uma relação diretamente proporcional entre
as concentrações desses hormônios.
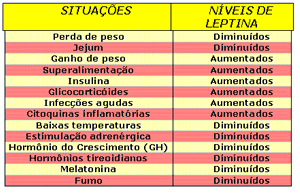
Glicocorticóides (como o cortisol), infecções
agudas e citoquinas inflamatórias; aumentam os
níveis de leptina mas, baixas temperaturas,
estimulação adrenérgica, hormônio do crescimento
(GH), hormônios tireoidianos, melatonina, e fumo têm
a propriedade de diminuir os níveis de leptina, como
observado na Tabela 1.
Há também o efeito do sexo, pois com a mesma
quantidade de gordura corporal
mulheres secretam
duas vezes mais leptina que homens. A
leptina humana tem uma meia-vida de aproximadamente
25 min e é a mesma em indivíduos obesos e com peso
corporal normal. Essa meia-vida curta na circulação
é determinada pelo clearence renal mediado
por filtração glomerular.
Tabela 1: Influência de fatores
orgânicos e ambientais nos níveis de
leptina.
|
Ingestão de alimentos x gasto de energia
O papel da leptina como
hormônio
antiobesidade é essencialmente derivado
de suas ações como diminuidor do apetite e
estimulador do gasto de energia. A propriedade
inibidora do apetite deve-se ao mecanismo de
sinalização desta no hipotálamo, estimulando a
síntese de neuropeptídeos anorexigênicos como
POMC (Proopiomelanocortina), a-MSH
(Hormônio Estimulante de a-Melanócitos), CRH
(Hormônio Liberador de Corticotropina) e CART
(Transcrito Regulado por Cocaína e Anfetamina) que
diminuem a ingestão de alimentos pela sensação de
saciedade. Os neuropeptídeos anorexigênicos, por sua
vez, inibem a síntese de neuropeptídeo Y
(NPY), que estimula a ingestão de alimentos, inibe a
termogênese (liberação de energia na forma de calor
sem produção de ATP) e é diminuido por altos
níveis séricos de insulina, promovendo aumento da
lipogênese, síntese proteica e armazenamento de
glicose.
A propriedade de alterar o gasto de energia,
deve-se ao fato da leptina estimular as ações da
norepinefrina (NOR) e a lipólise no tecido adiposo,
levando à termogênese. Por estimulação do sistema
nervoso simpático, a leptina causa aumento na
liberação de NOR que age em adipócitos por
sinalização via AMPcíclico e proteína quinase A (PKA),
estimulando a transcrição do gene para proteínas
desacopladoras da fosforilação oxidativa (UCPs). As
UCPs formam canais que permitem a entrada de prótons
na matriz mitocondrial sem passar através do
complexo ATP sintase, permitindo a oxidação contínua
de ácidos graxos sem síntese de ATP, com dissipação
de energia na forma de calor. Isto leva a um aumento
no gasto de energia no tecido adiposo, com estímulo
da lipólise.
|
Bibliografia
|
 |
ASHIMA, R. S., FLIER, J. S. Adipose
tissue as an endocrine organ. TEM, v.11,
n.8, p.327-332, 2000.
|
 |
CEDDIA, R. B., Jr. W. N. W., LIMA, F.
B., CARPINELLI, A.R., CURI, R. Pivotal
role of leptin in insulin effects. Braz.
J. of Med. and Biol. Res., v.31,
p.715-722,1998.
|
 |
CONSIDINE, R. V., CARO, J. F. Leptin and
the regulation of body weight. Int. J.
Biochem. Cell Biol., v.29, n.11,
p.1255-1272, 1997.
|
 |
DEVLIN, T.M. Textbook of Biochemistry
with clinical correlations, 1997, 4 ed.,
John Wiley & Sons, New York.
|
 |
HOUSEKNECHT K. L., PORTOCARRERO, C. P.
Leptin and its receptors: regulators of
whole-body energy homeostasis, v.15,
n.6, p.457-475, 1998.
|
 |
LEHNINGER, A. L., NELSON, D.L., COX,
M.M., Princípios de Bioquímica. 1995, 2
ed., Sarvier, São Paulo.
|
 |
MARZOCCO, A., TORRES, B.B., Bioquímica
Básica. 2 ed., 1999, Guanabara Koogan,
Rio de Janeiro.
|
 |
PERRONE, L., Del GIUDICE, E. M. Genetic
regulation of appetite and fatness:current
knowledge and future prospectives. Nutr.
Res., v.18, n.9, p.1631-1648, 1998.
|
 |
PROLO, P., WONG, M. L., LICINIO, J.
Leptin. Int. J. of Biochem. & Cell
Biol., v.30,p.1285-1290,1998.
|
 |
SCHUBRING, C., BLUM, W. F., KRATZSCH,
J., DEUTSCHER,J., KIESS, W. Leptin, the
ob gene product, in female health and
disease. Eur. J. of Obs. & Gin., v.88,
p.121-127, 2000 |
|
|
Os autores:
|
Este artigo foi uma colaboração de:
> Daniele Araújo, Formada em Farmácia
e Bioquímica/ UFMA; atualmente Mestranda no
departamento de Bioquímica, Instituto de
Biologia, Unicamp;
>José Antônio da Silva, Formado em
Biologia/ UFMS, atualmente Doutorando no
departamento de Bioquímica, Instituto de
Biologia, Unicamp.
>Leonardo Fernandes Fraceto, Químico/
UNICAMP; atualmente Doutorando no
departamento de Bioquímica, Instituto de
Biologia, Unicamp. |
|
|
|