|
 Das clínicas
para os campos de batalha. O explosivo preferido
dos filmes de ação nasceu em um laboratório de química: a
nitração de uma droga utilizada contra infecções urinárias
trouxe duas substâncias que estão entre os explosivos mais
potentes já preparados pelo homem. Das clínicas
para os campos de batalha. O explosivo preferido
dos filmes de ação nasceu em um laboratório de química: a
nitração de uma droga utilizada contra infecções urinárias
trouxe duas substâncias que estão entre os explosivos mais
potentes já preparados pelo homem.
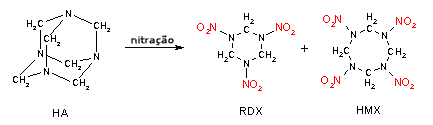
Durante a Segunda Guerra Mundial, a hexametilenetetramina
(HA), um composto comumente empregado em casos de infecções
urinárias, serviu como reagente de partida para a preparação
de dois explosivos: o RDX
e o HMX -
ciclometilenotrinitramina e ciclotetrametilentetranitramina,
respectivamente.
As siglas são uma apologia acrônima ao seu poder: Royal
Demolition eXplosive, RDX, e
Her Majesty's eXplosive, HMX. O
HMX é um dos explosivos com a maior velocidade de detonação
conhecida: mais de 9 kilômtros por segundo, ou seja, quase
33 mil kilômetros por hora!
Além de serem extremamente potentes, esta nova classe de
explosivos possuem qualidades invejáveis aos demais:
estabilidade, maleabilidade e
resitência ao calor. Os explosivos podem ser
moldados e aquecidos sem perigo de uma detonação indesejada.
Mas basta um pulso elétrico para que tudo vá pelos ares:
tanto o RDX como o HMX são capazes de derrubar paredes de
concreto ou mesmo de aço. O dinamite militar é uma mistura
de 75% RDX, 15% TNT e 10% de aditivos estabilizantes e
plastificantes. A mistura plástica explosiva conhecido como
C4 (o campeão
de vendas entre os terroristas) é composta por 91% RDX
e 9% de aditivos plastificantes. O poder de detonação do C4
é suficiente, por exemplo, para gerar ondas de compressão
capazes de iniciar a fissão nuclear de uma bomba de
urânio-235.
Em 1987, o laboratório do US Naval Air Warfare Center
Weapons Division sintetizou uma outra nitroamina
cíclica: a hexanitrohexaazaisowurtzitana, designada como
CL-20. Assim como o HDX e RDX, o CL-20 é estável e
maleável, mas cerca de 20% mais poderoso. Em um teste do
exército americano, uma bala de 30mm foi detonada em um
cartucho carregado com CL-20, e foi capaz de penetrar em
7 placas de 1 polegada de aço inox.
|
Alfred Nobel e a Nitroglicerina
|
A nitroglicerina é uma substância líquida, incolor e
oleosa, mas também altamente instável e explosiva. Basta um
simples toque para que ocorra uma detonação espontânea. Como
a molécula contém átomos de oxigênio, hidrogênio e carbono,
quando ela explode libera novas moléculas (como O2,
N2, H2
e CO2), mais estáveis, e
com uma grande energia cinética
(há uma conversão entre a
energia de ligação para energia cinética!). Esta
substância também foi utilizada como vaso-dilatador, nos
ataques cardíacos e anginas.
O nome nitroglicerina
vem de sua estrutura: ela é derivada da molécula
glicerina (uma
molécula biológica comum. serve de base para os
triglicerídeos) onde os grupos -OH são substituidos por -NO2.
O poder dos explosivos deve-se ao fato de que o volume
ocupado por um gás é muito maior do que o ocupado por um
sólido ou por um líquido. Veja a água, por exemplo. Enquanto
que 1 mol de água no estado líquido, a temperatura ambiente,
ocupa um volume de apenas 0,018 litros, esta mesma
quantidade de água, no estado gasoso, ocuparia um espaço de
mais de 20 litros! E, quanto maior for a temperatura, maior
será o volume do gás.
|
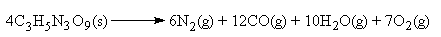
reação de decomposição da nitroglicerina sólida
|
É justamente a velocidade de sua
reação de decomposição
que faz com a nitroglicerina seja tão explosiva: a rápida
expansão dos gases quentes produzidos provoca uma onda de
choque supersônica. Pela estequeometria da reação acima, 4
moles de nitroglicerina (cerca de 900 gramas) são capazes de
gerar 35 moles de gases quentes (quase 800 litros de gases,
nas CNTP). Uma vantagem da nitroglicerina em relação aos
outros explosivos, como o
TNT (trinitrotolueno), é que, ao contrário deste,
nenhuma forma sólida de carbono é formada, produzindo uma
explosão sem fumaça - propriedade muito útil para a
artilharia. Assim, após o disparo, o soldado não ficaria com
a visão obscurecida por uma cortina de fumaça.
A nitroglicerina tem, entretanto, uma grande desvantagem: é
muito, mas muito mesmo, instável. É praticamente impossível
manusear ou transportar a substância. Muitas pessoas
perderam a vida tentando, até o problema ter sido
resolvido pelo químico
suéco Alfred Nobel.
 Nobel
estivera trabalhando em Stockholm, por vários anos, com a
nitroglicerina, que era preparada pela mistura de glicerol é
os ácidos sulfúrico e nítrico. Foram vários os acidentes
explosivos no laboratório, incluindo um em que seu
irmão, Emil Nobel e outras pessoas morreram. As
autoridades de Stockholm proibiram, então, experimentos com
nitroglicerina nos limites da cidade. Nobel mudou o seu
laboratório para Lake Malaren e, em 1864, encontrou a
solução. Nobel experimentou misturar nitroglicerina com
vários aditivos, numa tentativa de torná-la estável. Ele
logo descobriu que a mistura da nitroglicerina com um certo
tipo de argila, chamado kieselguhr, era muito
eficaz: tornava o líquido instável em uma pasta sólida
estável e maleável. No ano seguinte, em 1867, ele patenteou
a mistura com o nome "Dynamite". Atualmente, a
dinamite é feita com nitroglicerina, nitrato de amônio e
nitrato de sódio (2 outros explosivos), polpa de madeira e
um pouco de carbonato de cálcio para neutralisar os excessos
de ácidos que podem estar presentes. Nobel
estivera trabalhando em Stockholm, por vários anos, com a
nitroglicerina, que era preparada pela mistura de glicerol é
os ácidos sulfúrico e nítrico. Foram vários os acidentes
explosivos no laboratório, incluindo um em que seu
irmão, Emil Nobel e outras pessoas morreram. As
autoridades de Stockholm proibiram, então, experimentos com
nitroglicerina nos limites da cidade. Nobel mudou o seu
laboratório para Lake Malaren e, em 1864, encontrou a
solução. Nobel experimentou misturar nitroglicerina com
vários aditivos, numa tentativa de torná-la estável. Ele
logo descobriu que a mistura da nitroglicerina com um certo
tipo de argila, chamado kieselguhr, era muito
eficaz: tornava o líquido instável em uma pasta sólida
estável e maleável. No ano seguinte, em 1867, ele patenteou
a mistura com o nome "Dynamite". Atualmente, a
dinamite é feita com nitroglicerina, nitrato de amônio e
nitrato de sódio (2 outros explosivos), polpa de madeira e
um pouco de carbonato de cálcio para neutralisar os excessos
de ácidos que podem estar presentes.
Os propósito da dinamite era, segundo Nobel, auxiliar na
construção civil. Mas na primeira guerra mundial, foi
logo adotada como uma arma extremamente mortal. Logo após o
fim da guerra, um jornal publicou, erroneamente, o obituário
de Alfred Nobel, sem este ter realmente morrido. Nobel
percebeu que seria lembrado como o homem que criou o
explosivo e causou tantas mortes. Para limpar sua
consciência e seu nome, criou um instituto, que anualmente
distribui prêmios para trabalhos relevantes em
medicina, ciência e paz.
|
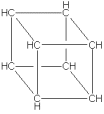
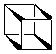
cubano
|
Uma molécula intrigante é o
cubano.
Sua fórmula molecular é C8H8:
um hidrocarboneto cúbico com ângulos de ligação de 90o,
desviando consideravelmetne do ângulo para carbonos com
hibridização sp3: 109,5o.
Embora "surrealista", a molécula é estável, e vendida
por várias empresas (a um custuo bem alto!). Estas
ligações "tensionadas" são extremamente energéticas.
Por isto seria muito grande o poder explosivo de um
octanitrocubano
(um cubano completamente nitrado): possuindo as instáveis
ligações nitro mais a energia torsional presente no cubano!
Seria, provavelmente, o mais potente explosivo do mercado.
Aguardem... tanto os penta- como os hexanitrocubanos
já foram sintetizados!
|
|