Ainda, olhando estas duas figuras (C e B),
podemos concluir que a
densidade (razão entre a massa e
o volume) é grande nestes dois estados, e que
provavelmente um sólido tenha uma densidade
ligeiramente maior do que o de seu líquido. E de
a densidade de ambos deve ser muito maior do que
a do gás, como ilustra a Figura (A). Neste
estado, as partículas estão muito afastadas uma
das outras, e parecem estar em constante
movimento aleatório.
A forma do conjunto das partículas de uma
amostra no estado gasoso é indefinida - na
verdade, um gás só tem forma se for confinado a
um recipiente; neste caso, assume a forma de seu
espaço interno. Em outras palavras,
o gás se difunde pelo meio até ocupar todo o
volume do recipiente que o confina.
Mais adiante, veremos que este comportamento
pode ser explicado pelo modelo cinético dos
gases: as partículas estão em movimento
constante e aleatório, com colisões elásticas.
Neste caso, o único
limite para a difusão do gás é a parede do
recipiente.
Se o frasco for aberto, as partículas do gás se
difundirão por toda a atmosfera, podendo até
mesmo escapar da atração gravitacional de nosso
planeta e rumar a esmo universo afora.
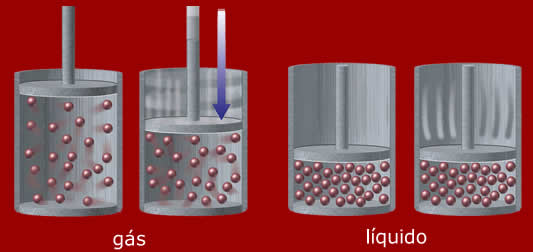
Uma outra grande diferença entre o estado gasoso
e os demais estados físicos é a
compressibilidade:
um gás pode ser
comprimido, mediante a aplicação de uma pressão,
muito mais fácil e amplamente que um líquido.
Na verdade, a redução de volume mediante a
aplicação de pressão sobre um líquido é quase
nula: por isto que utilizamos um fluido líquido
para transmitir a pressão aplicada ao pedal até
o freio de um automóvel. Se fosse um gás, o
único efeito do pedal seria o de comprimí-lo, e
o gás não seria freiado. Mais adiante,
estudaremos também o fator de compressibilidade
de um gás.
 Outro
fato interessante sobre gases é que, sob uma
mesma pressão e temperatura,
gases diferentes possuem
densidades diferentes. O gás
hélio, por exemplo, tem uma densidade de 161 mg/L
nas CATP (condições
ambientais de temperatura e pressão),
isto é, a massa de um litro de hélio a pressão
de 1 bar e a 25°C é de 161 miligramas. Já o
mesmo volume, nas mesmas condições, do gás
nitrogênio - o gás mais abundante da troposfera
- tem uma massa de 1,129 g, o que lhe dá uma
densidade de 1,129 g/L, nas CATP. E é justamente
esta propriedade- diferenças nas densidades -
que permite-nos voar em
um balão de gás. Isto é possível
pois o balão contém um gás de densidade menor do
que a densidade da troposfera - tal como
gás hélio, hidrogênio ou mesmo o
ar atmosférico aquecido (veremos
adiante que um gás de expande ao ser aquecido,
ficando menos denso). O balão irá subir,
então, até equalizar sua densidade (incluindo a
massa da carga e do próprio balão) com a
densidade da atmosfera.
Outro
fato interessante sobre gases é que, sob uma
mesma pressão e temperatura,
gases diferentes possuem
densidades diferentes. O gás
hélio, por exemplo, tem uma densidade de 161 mg/L
nas CATP (condições
ambientais de temperatura e pressão),
isto é, a massa de um litro de hélio a pressão
de 1 bar e a 25°C é de 161 miligramas. Já o
mesmo volume, nas mesmas condições, do gás
nitrogênio - o gás mais abundante da troposfera
- tem uma massa de 1,129 g, o que lhe dá uma
densidade de 1,129 g/L, nas CATP. E é justamente
esta propriedade- diferenças nas densidades -
que permite-nos voar em
um balão de gás. Isto é possível
pois o balão contém um gás de densidade menor do
que a densidade da troposfera - tal como
gás hélio, hidrogênio ou mesmo o
ar atmosférico aquecido (veremos
adiante que um gás de expande ao ser aquecido,
ficando menos denso). O balão irá subir,
então, até equalizar sua densidade (incluindo a
massa da carga e do próprio balão) com a
densidade da atmosfera.
Então, será que já podemos responder a pergunta
que está no título desta aula?
O que é um gás?
Bem, ainda precisamos de muitas definições e
conceitos que veremos nas próximas etapas.
Todavia, já podemos definir um gás da maneira
como este é definido pela Teoria
Cinética Molecular dos Gases, ou modelo
cinético dos gases.
 Em
acordo com o modelo cinético:
Em
acordo com o modelo cinético: