EFEITOS
dos substituintes na ORIENTAÇÃO
Como vimos anteriormente, a presença de substituintes no
anel benzênico exerce um forte efeito sobre a sua
reatividade, isto é, sobre a velocidade da reação de
substituição eletrofílica. Veremos, agora, que estes
substituintes também influenciam na orientação da
substituição: algumas posições são privilegiadas, em
detrimento de outras.
Quando um benzeno mono-substituído sofre uma reação de
substituição eletrofílica, onde se dá o ataque do
eletrófilo? Na posição orto, meta ou para? Ou nas
três? Qual isômero é o produto?
A posição do ataque é
determinada pelo substituinte já ligado ao
anel. Os substituintes podem ser divididos em dois
grupos: orientadores orto-para ou orientadores meta.
É muito fácil saber se um determinado substituinte é um
orientador orto-para ou um orientador meta. Todos os
orto-para possuem um par de elétrons não ligante no
átomo diretamente ligado ao anel (com excessão de grupos
alquilas, arilas e vinilas). Todos os orientadores
meta possuem uma carga positiva (ou uma carga
parcial positiva) sobre o átomo ligado diretamente ao
anel.
Para entender a origem desta orientação seletiva,
devemos olhar para a
estabilidade do intermediário carbocátion
formado na primeira etapa da reação (recorde que esta é
a etapa determinante da velocidade!). Este é o passo
fundamental para a compreensão da orientação da
reatividade. Quando um benzeno substituído sofre uma
reação de substituição eletrofílica, 3 diferentes
carbocátions podem ser formados; comparando as
estabilidades relativas destes carbocátions, somos
capazes de prever o caminho preferido pela reação, pois
quanto mais estável for o intermediário, menor será a
energia necessária para obtê-lo.
Um grupo doador de elétrons (como o -CH3),
por exemplo, irá tornar estável os carbocátions onde a
carga positiva, em uma das formas ressonânticas,
encontra-se sobre o carbono do anel ligado a este grupo.
Isto só ocorre quando o eletrófilo se liga nas posições
orto e para, como ilustra a figura abaixo. Isto
significa que, em suma,
qualquer substituinte que seja doador de elétrons
- indutiva ou
ressonanticamente - é um orientador orto-para.
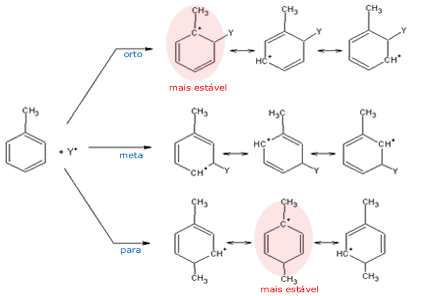 Apenas duas posições são capazes de
gerar carbocátions que podem ser
estabilizados pelo substituinte do anel:
as posições orto e para.
Apenas duas posições são capazes de
gerar carbocátions que podem ser
estabilizados pelo substituinte do anel:
as posições orto e para.
|
O mesmo ocorre com substituintes que doam elétrons por
ressonância: estes elétrons são capazes de estabilizar
os carbocátions referentes ao carbono substituido, isto
é, também favorecem as posições orto e para.
Os substituintes que possuem uma
carga positiva
(ou mesmo uma carga parcial positiva) no átomo
diretamente ligado ao anel benzênico
sacam elétrons do anel;
neste caso, os carbocátions que possuem carga positiva
sobre o carbono substituido do anel são particularmente
instáveis, pois este carbono já encontra-se
elétron-deficiente. Então, ao contrário dos
substituintes vistos anteriormente, os isômeros mais
estáveis com estes substituintes são os da
posição meta,
já que a orto e a para resultam de carbocátions menos
estáveis.
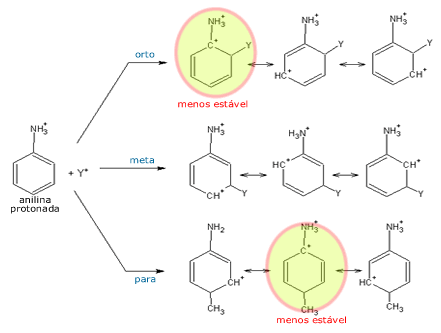 Neste caso, se o eletrófilo se ligar às
posições orto ou para, formará
carbocátions particularmente instáveis -
a carga positiva encontra-se sob um
sacador eletrônico. A orientação
preferencial é, portanto, a posição
meta.
Neste caso, se o eletrófilo se ligar às
posições orto ou para, formará
carbocátions particularmente instáveis -
a carga positiva encontra-se sob um
sacador eletrônico. A orientação
preferencial é, portanto, a posição
meta.
|
Perceba que as formas mesoméricas para todos os
substituintes, frentes a adição eletrofílica, são as
mesmas (repare nas duas últimas figuras). O que
determina a orientação é a contribuição do substituinte
já presente na estabilização do carbocátion; no primeiro
caso, as posições orto e para eram eram as preferidas
porque os respectivos carbocátions eram estabilizados
pelo substituinte; no segundo caso, ocorria o oposto:
estas posições eram desfavorecidas justamente pela
presença deste substituinte.
EFEITOS
dos substituintes no pKa
|
Quanto mais desativante (sacador
eletrônico) for o substituinte, maior
será a acidez de um grupo -OH, -COOH ou
-N+H3
ligado ao anel benzênico.
|
A habilidade de um substituinte de doar ou sacar
elétrons do anel benzênico pode ser refletida nos
valores de pKa
de fenóis, ácidos benzóicos e anilinas
protonadas. Por exemplo: o pKa
do fenol em água a 25oC
é 9,95. Já o pKa
do para-clorofenol nas mesmas condições é
menor (9,38), enquanto que do para-metilfenol
é maior (10,19). Qual é a razão para este fenômeno?
Bem, pensemos um pouco: quando fenol perde o próton
ácido, o anel benzênico é responsável pela
estabilização da carga negativa do fenóxido formado.
Se o anel possuir um substituinte que doe mais
elétrons, esta estabilização fica mais difícil; logo
a desprotonação do fenol só ocorre a um pH maior (ou
seja, maior pKa).
É o que ocorre com o grupo metil, por exemplo. Já no
caso do para-clorofenol, o oposto se verifica: o
cloro é mais eletronegativo do que o carbono, por
isso saca elétrons do anel, ajudando na
estabilização do íon fenóxido. Por isso, este fenol
é mais ácido - tem um pKa
menor.
Na figura acima percebe-se que quanto mais o
substituinte saca elétrons do anel, mais ácido é o fenol
resultante. Da mesma forma, quanto mais forte for o
doador de elétrons, maior é o pKa
do fenol substituído.
Efeitos similares são observados nos derivados de ácido
benzóico e do anilínio, como ilustra a figura abaixo.
|
HomeWork
|
Olhe para a figura acima. O
para-nitroanilínio é 3,60 unidades de
pKa
mais ácido do que o íon anilínio, mas o ácido para-nitrobenzóico é
somente 0,76 unidades de pKa
mais ácido do que o ácido benzóico.
Explique por que o substituinte nitro
causa uma mudança maior no pKa
em um caso e menor em outro.
Esta tarefa é para você fazer em casa! |
|