 EFEITOS1
EFEITOS1
|
EFEITOS
dos substituintes na reatividade
Efeito indutivo...
mesomérico...
lembra?! Senão, chegou a hora de você relembrar. E, caso
nunca tenha visto, o Portal de
Estudos em Química vai lhe ensinar, de uma maneira
muito simples. Estamos falando sobre os efeitos provocados,
pelos substituintes, na reatividade do benzeno. Vimos, até
então, que tanto o benzeno como os seus derivados podem
sofrer reações. Estudamos as reações de substituições
eletrofílicas no anel aromático. Veremos, agora, que os
substituintes podem "dirigir" estas reações para partes
específicas do anel ou, ainda, impedir que uma determinada
reação aconteça com o benzeno. Tudo isto, graças a efeitos
eletrônicos dos substituintes.
|
Você sabia?
|
 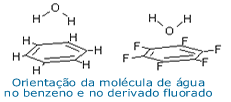 O
benzeno, embora seja uma molécula apolar, tem
uma atração por cátions mais forte do que por
ânions. Vários trabalhos mostram que, de fato,
cátions de amônio quaternários ligam-se
eletrostaticamente ao benzeno. Em nosso
organismo, vários receptores nas células contém
anéis aromáticos, capazes de reconhecer, nos
transmissores, os grupos catiônicos. O
benzeno, embora seja uma molécula apolar, tem
uma atração por cátions mais forte do que por
ânions. Vários trabalhos mostram que, de fato,
cátions de amônio quaternários ligam-se
eletrostaticamente ao benzeno. Em nosso
organismo, vários receptores nas células contém
anéis aromáticos, capazes de reconhecer, nos
transmissores, os grupos catiônicos.
A experiência mostra que a densidade eletrônica
do benzeno depende de seus substituintes; no
caso do hexafluorbenzeno, por exemplo, o benzeno
passa a ser eletrofílico!
Saiba
mais:
>> Kier, L.B.; Aldrich, H.S. A . J. theor. Biol.
1974, 46, 529-541.
>> Gallivan, J.P.; Dougherty, D.A. Org. Lett.
1999, 1, 103-105.
>> Dougherty, D.A.. Science 1996, 271, 163-168.
|
Esta etapa será dividida em duas partes: na primeira,
veremos os efeitos dos
substituintes na reatividade do anel frente à
substituição eletrofílica; na segunda, veremos a orientação
preferencial imposta pelos substituintes nestas reações.
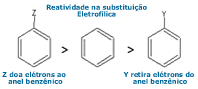 Será
um benzeno substituído
mais ou menos reativo do que o próprio benzeno,
perante uma substituição eletrofílica? A resposta depende do
substituinte; alguns o fazem mais, outros o fazem menos
reativo. A etapa determinante da velocidade nesta reação,
tal como vimos anteriormente, é o ataque do anel aromático
nucleofílico sobre o eletrófilo positivamente carregado. Por
exemplo: um substituinte que aumente a densidade eletrônica
do anel favorece a reação, por que provoca um aumento de sua
nucleofilicidade. Quanto maior a nucleofilicidade, maior a
velocidade de ataque ao eletrófilo e, consequentemente,
maior a velocidade da reação. Portanto,
substituintes que são capazes
de doar elétrons ao anel irão aumentar a velocidade da
substituição eletrofílica, enquanto que substituintes que
sugam elétrons do anel diminuem a velocidade desta reação. Será
um benzeno substituído
mais ou menos reativo do que o próprio benzeno,
perante uma substituição eletrofílica? A resposta depende do
substituinte; alguns o fazem mais, outros o fazem menos
reativo. A etapa determinante da velocidade nesta reação,
tal como vimos anteriormente, é o ataque do anel aromático
nucleofílico sobre o eletrófilo positivamente carregado. Por
exemplo: um substituinte que aumente a densidade eletrônica
do anel favorece a reação, por que provoca um aumento de sua
nucleofilicidade. Quanto maior a nucleofilicidade, maior a
velocidade de ataque ao eletrófilo e, consequentemente,
maior a velocidade da reação. Portanto,
substituintes que são capazes
de doar elétrons ao anel irão aumentar a velocidade da
substituição eletrofílica, enquanto que substituintes que
sugam elétrons do anel diminuem a velocidade desta reação.
Existem duas formas nas quais os substituintes podem doar
elétrons a um anel benzênico: doação eletrônica indutiva ou
doação eletrônica por ressonância. Da mesma forma, existem
dois tipos de saque eletrônico: indutivo e por ressonância.
Veremos cada um dos casos separadamente, a seguir.
> Doação e saque eletrônico INDUTIVO
O único tipo de ligação possível para um substituinte do
anel é a ligação s.
É este o tipo de ligação entre os hidrogênios e os carbonos,
no benzeno. Nesta ligação, um par eletrônico é compartilhado
entre o carbono e seu ligante. Este par de elétrons,
entretanto, pode ser mais facilmente atraído por uma das
partes. Se os elétrons de uma ligação com um determinado
substituinte puderem ser mais facilmente atraídos pelo anel
do que os elétrons de uma ligação com o hidrogênio, diz-se
que este substituinte é um doador eletrônico indutivo. Se,
entretanto, os elétrons de uma ligação s
com um determinado substituinte forem menos atraídos pelo
anel, comparados aos elétrons de uma ligação
s com o hidrogênio, este
substituinte é um sacador eletrônico indutivo.
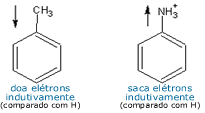 Este
comportamento está, em geral, associado com a
eletronegatividade do grupo substituinte. Entretanto, nem
sempre uma consulta nos valores de eletronegatividade pode
oferecer uma resposta correta. Vejamos o caso do tolueno:
será que o grupo -CH3
doa elétrons para o anel mais ou menos facilmente do que o
hidrogênio? Embora a eletronegatividade do
carbono seja maior do que a do hidrogênio (sugerindo que o
metil fosse um sacador eletrônico) a resposta correta é que
o metil DOA elétrons para o anel mais facilmente do que o
hidrogênio. Deve-se levar em conta, também, a
disponibilidade eletrônica do substituinte: no caso do
hidrogênio, existe apenas um elétron, que circula o seu
núcleo. Já no caso do grupo metil, além dos 6 elétrons do
carbono, existem também os elétrons compartilhados com os
hidrogênios que estão ligados a ele. Desta forma, pode-se
dizer que a doação de elétrons para o anel é mais estável no
grupo metil, em relação ao hidrogênio. O oposto ocorre com o
grupo -NH3+:
o nitrogênio é mais eletronegativo do que o carbono e, não
obstante, a carga positiva sobre este átomo o deixa
eletronicamente deficiente, e ele tende a suprir esta
demanda sugando elétrons do anel. Este é um exemplo de
sacador eletrônico indutivo. Este
comportamento está, em geral, associado com a
eletronegatividade do grupo substituinte. Entretanto, nem
sempre uma consulta nos valores de eletronegatividade pode
oferecer uma resposta correta. Vejamos o caso do tolueno:
será que o grupo -CH3
doa elétrons para o anel mais ou menos facilmente do que o
hidrogênio? Embora a eletronegatividade do
carbono seja maior do que a do hidrogênio (sugerindo que o
metil fosse um sacador eletrônico) a resposta correta é que
o metil DOA elétrons para o anel mais facilmente do que o
hidrogênio. Deve-se levar em conta, também, a
disponibilidade eletrônica do substituinte: no caso do
hidrogênio, existe apenas um elétron, que circula o seu
núcleo. Já no caso do grupo metil, além dos 6 elétrons do
carbono, existem também os elétrons compartilhados com os
hidrogênios que estão ligados a ele. Desta forma, pode-se
dizer que a doação de elétrons para o anel é mais estável no
grupo metil, em relação ao hidrogênio. O oposto ocorre com o
grupo -NH3+:
o nitrogênio é mais eletronegativo do que o carbono e, não
obstante, a carga positiva sobre este átomo o deixa
eletronicamente deficiente, e ele tende a suprir esta
demanda sugando elétrons do anel. Este é um exemplo de
sacador eletrônico indutivo.
> Doação e saque eletrônico por RESSONÂNCIA
Quando o substituinte possui, sobre o átomo diretamente
ligado ao anel benzênico, um par de elétrons não ligantes,
estes elétrons podem ser deslocalizados para o anel, através
da sobreposição de orbitais p. Tais substituintes são
chamados de doadores eletrônicos por ressonância. Grupos
como -NH2, -OH, -OR ou Cl são
doadores eletrônicos por ressonância, embora também sejam
sacadores eletrônicos indutivos, pois são mais
eletronegativos do que um hidrogênio.
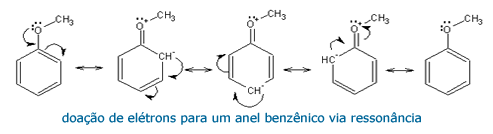 |
Da mesma forma, grupos
podem sacar elétrons via ressonância. Isto ocorre
quando o substituinte é ligado por um átomo que possui uma
ligação dupla ou tripla com um outro átomo, mais
eletronegativo. Os elétrons p do
anel podem, então, ser deslocalizados em direção ao
substituinte. Estes grupos são chamados de sacadores
eletrônicos por ressonância. Exemplos destes grupos são os
substituintes -C=O, -CN, NO2, e -SO3H.
Estes grupos também são sacadores eletrônicos indutivos,
pois são mais eletronegativos do que o hidrogênio.
Muitos grupos exibem ambos os fenômenos: indutivo e por
ressonância. Na hora de julgar qual vai ser o
efeito global sobre a
reatividade, é necessário levar em conta ambas as
contribuições. A tabela abaixo resume os principais efeitos
de alguns substituintes do benzeno na reatividade frente a
substituição eletrofílica.
|
ativantes fortes
|
ativantes moderados
|
ativantes fracos
|
desativantes fracos
|
desativantes moderados
|
desativantes fortes
|
-NH2
-NHR
-NR2
-OH
-OR |
-NHC(O)R
-OC(O)R
|
-R
-Ar
-CH=CR2
|
-F
-Cl
-Br
-I |
-C(O)H
-C(O)R
-C(O)OR
-C(O)OH
-C(O)Cl |
-+NH3
-+NH2R
-+NR3
-+NH2R
-NO2
-CN
-SO3H |
|
|
|