 DETERMINAÇÃO
DE FÓRMULAS
DETERMINAÇÃO
DE FÓRMULAS
1. IntroduçãoQuando um químico se depara com um material desconhecido, por exemplo, uma amostra de uma pedra lunar ou de um meteorito, ou ainda de uma matéria encontrada em uma caverna que está sendo explorada, ele procura, através de diversas técnicas físicas e químicas, encontrar a composição desse material.
A primeira providência é fazer a análise imediata do material, isto é, separar através de processos puramente físicos as diversas substâncias presentes na amostra.Esses processos baseiam-se no fato de que o conjunto de características, como ponto de fusão, ponto de ebulição, densidade, solubilidade, é diferente para cada substância e, manejando criteriosamente essas diferenças, consegue-se separá-las uma a uma.
Uma vez separadas as diversas substâncias da amostra, a próxima providência é fazer uma análise elementar de cada uma delas.
A análise elementar divide-se em qualitativa, cuja finalidade é descobrir os tipos de elementos que formam a substância; e quantitativa, que tem por finalidade descobrir a proporção em que estes elementos aparecem, ou seja, descobrir a fórmula da substância.
Resumindo, temos:

Suponhamos que o químico submeteu 10,0 g de um material inicial à análise imediata e isolou 7,5 g de uma substância X. Esta substância, submetida à análise qualitativa e, em seguida, à análise quantitativa, revelou:

Prosseguindo com seus métodos analíticos, chegou à conclusão de que a massa molecular dessa substância era 180.
Com base nesses dados, o químico já pode determinar com certeza 3 tipos de fórmula para essa substância: fórmula percentual, fórmula mínima e fórmula molecular.
Fórmula Percentual ou Composição Centesimal
Para obter a fórmula percentual, basta calcular a composição centesimal dos elementos formadores, ou seja, descobrir as percentagens em massa de cada elemento.

![]()

![]()
Uma outra maneira de encontrar a fórmula percentual é através da fórmula molecular da substância.
Por exemplo, partindo-se da fórmula molecular do ácido acético (C2H4O2) é possível determinar sua composição centesimal. Deve-se conhecer também as massas atômicas: H = 1; C = 12; O = 16.

Portanto, uma molécula de ácido acético, de massa 60 u, é formada por 24 u de carbono, 4 u de hidrogênio e 32 u de oxigênio. O cálculo da composição centesimal fica:



Concluindo, podemos dizer que em cada 100 g de ácido acético encontramos 40 g de carbono, 6,67 g de hidrogênio e 53,33 g de oxigênio.
3. Fórmula Mínima, Empírica ou Estequiométrica
Indica os elementos que formam a substância e a proporção em número de átomos ou em mols de átomos desses elementos expressa em números inteiros e menores possíveis.
A determinação da fórmula mínima de uma substância pode ser feita de duas maneiras:
I. A partir das massas dos elementos que se combinam para formar a substância.
Como foi visto no módulo anterior:
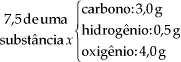
Sabendo-se que
![]() ,
poderemos fazer diretamente o cálculo usando as massas obtidas na análise
elementar:
,
poderemos fazer diretamente o cálculo usando as massas obtidas na análise
elementar:
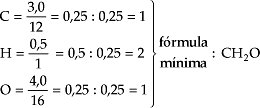
Após o cálculo da quantidade em mols, como não conseguimos os menores números inteiros possíveis, dividimos todos os números pelo menor deles.
Observação – Caso ainda não seja conseguida a seqüência de números inteiros, devemos multiplicar todos os números por um mesmo valor.
II. A partir da composição centesimal.
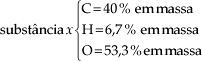
Concluímos que em 100 g da substância x encontramos: 40 g de carbono, 6,7 g de hidrogênio e 53,3 g de oxigênio. O cálculo da fórmula mínima deve ser feito da seguinte maneira.

4. Fórmula Molecular
Indica os elementos e o número de átomos de cada elemento em 1 molécula ou em 1 mol de moléculas de substância. Para o cálculo da fórmula molecular é necessário que se conheça inicialmente a massa molecular, que no caso é 180, e seguir um dos dois caminhos:
I. Partindo da fórmula mínima

II. Partindo da composição centesimal

Concluindo, podemos dizer que 1 molécula da substância x é formada por 6 átomos de carbono, 12 átomos de hidrogênio e 6 átomos de oxigênio ou 1 mol de moléculas de x é formada por 6 mols de átomos de carbono, 12 mols de átomos de hidrogênio e 6 mols de átomos de oxigênio.
Este site foi atualizado em 04/03/19