 LEIS
PONDERAIS
LEIS
PONDERAIS
No final do século XVIII, a Química se firma como “ciência”, principalmente devido aos experimentos e observações de cientistas, como Lavoisier, Proust e Dalton. Esses experimentos foram realizados com base nas observações das massas das substâncias que participavam dos fenômenos químicos, daí o nome leis Ponderais.
1. Lei de Lavoisier (Lei da conservação das massas)
Antoine Laurent Lavoisier foi o primeiro cientista a dar conotação científica à Química. No final do século XVIII, ele fazia experiências nas quais se preocupava em medir a massa total de um sistema, antes e depois de ocorrer a transformação química.
Exemplo
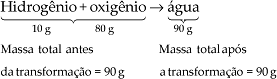
Através da análise dos dados obtidos em várias experiências, chegou à conclusão que:
Num sistema fechado, a massa total das substâncias, antes da transformação química, é igual à massa total após a transformação ou Na natureza nada se perde, nada se cria, tudo se transforma.
2. Lei de Proust (Lei das proporções fixas ou definidas)
Proust se preocupava em analisar a composição das substâncias. Trabalhando com amostras de água de várias procedências (água de chuva, água de rio, água de lago, previamente purificadas), e decompostas por eletrólise, ele verificou que:

Assim, Proust concluiu que:
Independentemente da origem de uma determinada substância pura, ela é sempre formada pelos mesmos elementos químicos, combinados entre si na mesma proporção em massa.
Uma das conseqüências da lei de Proust é a composição centesimal das substâncias, que indica a porcentagem, em massa, de cada elemento que constitui a substância.
Exemplo
No caso da água, temos:
90 g de água fornece 10 g de hidrogênio e 80 g de oxigênio.
![]()
x = 11,11% de hidrogênio
![]()
x = 88,88% de oxigênio
Outra conseqüência da lei de Proust é o cálculo estequiométrico.
Hidrogênio + oxigênio → água
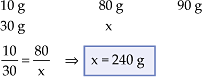
Para 10 g de hidrogênio precisamos de 80 g de oxigênio para reagir, em 30 g de hidrogênio precisamos de 240 g de oxigênio. Logo, a proporção, em massa, com que o hidrogênio reage com o oxigênio é a mesma nas duas reações.
Este site foi atualizado em 04/03/19