 Teoria
de Arrhenius
Teoria
de Arrhenius

Svante August Arrhenius (1859-1927)
Arrhenius, físico e químico de nacionalidade sueca, nasceu em Wijk, em 1859. Aos 22 anos de idade, Arrhenius já havia realizado muitas experiências relacionadas com a passagem da eletricidade através de soluções aquosa. Durante dois anos, trabalhando no laboratório da Universidade de Upsala, colecionou vários dados sobre centenas de soluções e concentrações. Formulou, então uma hipótese, de que as soluções aquosas contêm partículas carregadas, isto é, íons.
Tratava-se de uma proposição revolucionária e seus professores a acharam tão diferente de suas próprias idéias que, muito a contra-gosto, concederam-lhe o grau de doutor.
Sem se deixar desencorajar, Arrhenius enviou cópias de sua tese a outros cientistas. Embora muito poucos tenham tomado a sério suas idéias radicais, o grande cientista alemão Ostwald ficou tão entusiasmado que viajou para a Suécia a fim de encontrar-se com Arrhenius. Estimulado por esse apoio, Arrhenius foi estudar na Alemanha e Holanda. Finalmente, em 1889, foi publicado seu trabalho sobre a "Dissociação das Substâncias Aquosas".
Embora convidado a ir para Leipzig como professor da Universidade preferiu voltar á Suécia como conferencista e professor secundário em Estocolmo. Sua teoria ainda não havia conquistado aceitação geral e os que eram contra apelidavam os seus adeptos de "horda selvagem de Ionianos". Dois anos após esta nomeação foi eleito Presidente da Universidade e recebeu o prêmio Nobel, tendo sido o terceiro a recebê-lo no campo da Química. Finalmente, era Arrhenius reconhecido como um grande cientista, como há muito o merecia. Foi-lhe oferecida a ambiciosa posição de professor de Química na Universidade de Berlim, mas tendo o rei da Suécia fundado o Instituto Nobel de Físico-Química, em 1905 Arrhenius tornou-se seu diretor. Continuou sendo um pesquisador incansável e um cientista extremamente versátil até sua morte, em 1927.
DISSOCIAÇÃO IÔNICA X IONIZAÇÃO
Para entendermos
a Teoria de Arrhenius, vamos testar a condutividade elétrica de várias
soluções, utilizando a aparelhagem ilustrada a seguir:
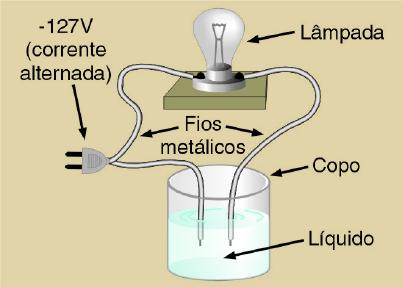
Testando a condutividade elétrica de algumas soluções utilizando a aparelhagem acima, verificou-se que:
|
Materiais |
Condutibilidade elétrica |
|
Solução de sal de cozinha (NaCl) |
Conduz |
|
Solução de ácido clorídrico (HCl) |
Conduz |
|
Solução de açúcar (sacarose) |
Não conduz |
|
Água destilada (pura) |
Não conduz |
|
Água potável (torneira) |
Conduz |
De acordo com estes resultados surgem alguns questionamentos:
1º) Por que algumas soluções aquosas conduzem eletricidade, e outras não?
2º) Por que a água destilada (pura) não conduz eletricidade e a água potável (torneira) conduz?
Para responder a tais questionamentos, Arrhenius estabeleceu a Teoria da Dissociação Iônica, onde a condutividade elétrica das soluções era devido à existência de íons livres.Vamos entender a razão pela qual algumas soluções conduzem eletricidade e outras não.
1º) Testando a condutividade elétrica de uma solução de água com sal de cozinha (NaCl) verificou-se que a lâmpada acendeu, indicando que esta solução conduziu corrente elétrica.
Observação macroscópica:
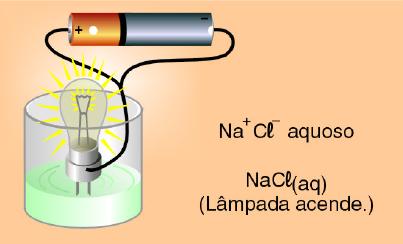
Explicação microscópica:
O sal de cozinha é representado pela substância cloreto de sódio – NaCl – que é um composto iônico constituído pelos íons Na+ e Cl- organizados através de um retículo cristalino.
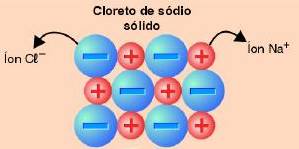
Quando o retículo cristalino de cloreto de sódio entra em contato com a água, ocorre uma separação dos íons, fenômeno denominado de dissociação iônica. Os íons livres obtidos após a dissociação, são os responsáveis pela condutividade elétrica.
Este processo de dissociação iônica pode ser representado através da seguinte equação:
NaCl(s)
![]() Na+(aq)
+ Cl-(aq)
Na+(aq)
+ Cl-(aq)
2º) Testando a condutividade elétrica de uma solução de água com açúcar verificou-se que a lâmpada se manteve apagada, indicando que esta solução não conduziu corrente elétrica.
Observação macroscópica:
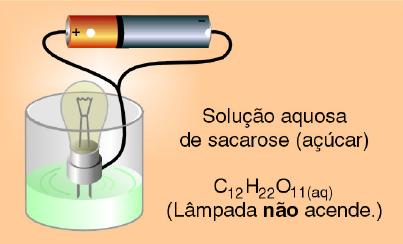
Explicação microscópica:
O açúcar é representado pela substância sacarose – C12H22O11 – de natureza molecular.
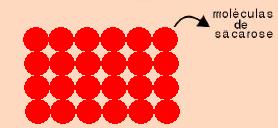
A molécula de sacarose não possui íons e também não originou íons em presença de água, o que explica o fato da não condutibilidade elétrica. Quando as moléculas de sacarose foram colocadas em presença de água, ocorreu apenas uma separação das moléculas, fenômeno denominado de dissociação molecular.
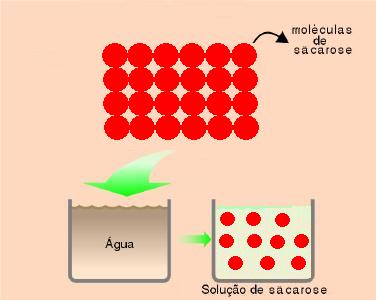
Este processo de dissociação molecular pode ser representado através da seguinte equação:
C12H22O11(s)
![]() C12H22O11(aq)
C12H22O11(aq)
3º) Testando a condutividade elétrica de uma solução de água com cloreto de hidrogênio (HCl) verificou-se que a lâmpada acendeu, indicando que esta solução conduziu corrente elétrica.
Observação macroscópica:
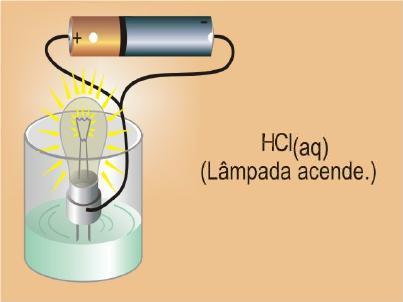
Explicação microscópica:
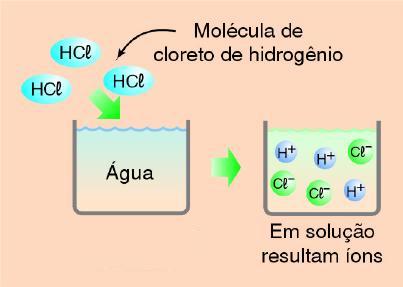
Veja que caso interessante! O cloreto de hidrogênio (HCl) é um composto molecular, ou seja, não é constituído por íons. No entanto, quando adicionado em água, originou uma solução condutora de eletricidade, que indica que a solução resultante possui íons. Como isto ocorre?
Como vimos, em ligação covalente, o cloreto de hidrogênio (HCl) é uma molécula onde o átomo de hidrogênio (Z = 1) compartilha 1 par de elétrons com o átomo de cloro (Z = 17):

Quando o cloreto de hidrogênio é borbulhado na água, admite-se que ocorra uma quebra na ligação covalente entre o átomo de hidrogênio e o átomo de cloro, pela molécula de água, originando os íons H+ e Cl-, responsáveis pela condutibilidade elétrica da solução. A este fenômeno, onde os íons foram produzidos a partir de um composto molecular (sem íons) é denominado de ionização, que pode ser representado esquematicamente por:
HCl(g)
![]() H+(aq)
+ Cl-(aq)
H+(aq)
+ Cl-(aq)
Observação:
1º) Atualmente, sabe-se que o cátion H+, proveniente da molécula do HCl, se une a uma molécula de água formando o íon H3O+, denominado hidroxônio ou hidrônio.
H+ + H2O → H3O+
Desta forma, a representação mais correta para o processo de ionização do HCl, ficará assim:
HCl + H2O → H3O+ + Cl-
Mas por questão de simplificação utilizaremos a primeira representação.
2º) GRAU DE IONIZAÇÃO OU DISSOCIAÇÃO (α)
Quando uma substância dissolve-se em água, não são todas as moléculas que irão sofrer ionização ou dissociação (quebra da molécula) com produção de íons. O grau de ionização ou dissociação (α) indica a porcentagem de moléculas que sofrem ionização ou dissociação que por sua vez mede a força do eletrólito, ou seja, quanto maior o grau de ionização do eletrólito, maior é a sua força.
Ficou convencionado que: eletrólitos fortes possuem α ≥ 50%, eletrólitos moderados possuem 5% < α < 50% e eletrólitos fracos possuem α ≤ 5%.
Ex.: Calcule o grau de ionização (α) do ácido clorídrico, sendo que de 100 moléculas dissolvidas, 90 moléculas sofreram ionização e classifique-o em forte, moderado ou fraco.
Resolução:
100 moléculas dissolvidas → 100%
90 moléculas ionizadas →
= 90%
Interpretação:
90% das moléculas do ácido clorídrico sofreram ionização, sendo classificado como um eletrólito forte.
4º) Testando a condutividade elétrica de uma solução de água destilada verificou-se que a lâmpada se manteve apagada, indicando que a água pura não conduziu corrente elétrica.
Observação macroscópica:
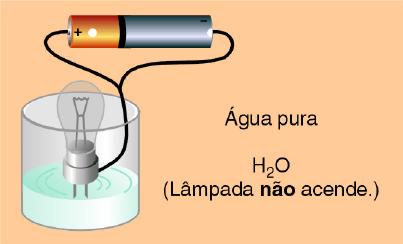
Explicação microscópica:
Pelos conceitos que aprendemos até agora, observamos que a água não conduziu eletricidade, com isso, podemos deduzir que não existem íons em solução, certo?
Errado! Atualmente, sabe-se que a água sofre um processo de auto-ionização, onde suas moléculas se unem ionizando-se umas às outras.
![]()
Mas, se existem íons em solução, por que então a água pura não conduz eletricidade? O fato é que apenas duas moléculas de cada um bilhão sofrem ionização, com isso a quantidade de íons produzidos não é suficiente para que ocorra a condutividade elétrica.
Agora que sabemos que a água destilada (pura) não conduz eletricidade, como explicar então, o fato da água potável conduzir eletricidade?
A água destinada ao abastecimento das cidades, ou seja, a água potável, é proveniente dos rios, lagos ou represas e contém dois tipos de impurezas: materiais sólidos em suspensão, como areia, restos de animais e vegetais mortos, etc., que geralmente se separam quando a água permanece em repouso e materiais que não se separam nestas condições, como bactérias, substâncias solubilizadas, sais solúveis, etc.
Esta água sofre um processo de tratamento físico e químico, que envolve etapas tais como: floculação, decantação, filtração e desinfecção, onde são adicionadas várias substâncias químicas com a finalidade de deixar a água em condições de ser consumida pela população. Estas substâncias químicas dissolvidas na água originam íons, que são responsáveis pela condutibilidade elétrica desta solução.TERMOS TÉCNICOS UTILIZADOS POR ARRHENIUS
Em função dos experimentos realizados através da condutividade elétrica de substâncias em presença de água, Arrhenius estabeleceu alguns termos técnicos utilizados de acordo com os resultados obtidos em suas experiências:
· Solução eletrolítica ou iônica à soluções que conduzem eletricidade.
Ex.: água + sal de cozinha (NaCl) e água + cloreto de hidrogênio (HCl).
· Solução não-eletrolítica ou molecular à soluções que não conduzem eletricidade.
Ex.: água + açúcar (sacarose).
· Eletrólitos à substâncias dissolvidas em água, que não conduzem eletricidade.
Ex.: NaCl e HCl
· Não-eletrólitos à substâncias dissolvidas em água, que não conduzem eletricidade.
Ex.: açúcar (sacarose).
· Dissociação molecular à separação de substâncias moleculares, sem formação de íons, originando uma solução não-eletrolítica, ou seja, que não conduz eletricidade.
Ex.: C12H22O11(s)
![]() C12H22O11(aq)
C12H22O11(aq)
· Dissociação iônica à separação dos íons de substâncias iônicas, originando uma solução eletrolítica, ou seja, que conduz eletricidade.
Ex.:
NaCl(s)
![]() Na+(aq)
+ Cl-(aq)
Na+(aq)
+ Cl-(aq)
· Ionização à transformação de uma substância molecular em íons, originando uma solução eletrolítica, ou seja, que conduz eletricidade.
Ex.:
HCl(g)
![]() H+(aq)
+ Cl-(aq)
H+(aq)
+ Cl-(aq)
DEFINIÇÃO DE ÁCIDO E BASE SEGUNDO ARRHENIUS
De acordo com Teoria da Dissociação Iônica, onde a condutividade elétrica das soluções era devido à existência de íons livres, Arrhenius propôs uma definição para ácidos e para bases.

Ex.: HCl
![]() H+(aq)
+ Cl-(aq)
H+(aq)
+ Cl-(aq)
Atualmente, sabemos que os ácidos são substâncias moleculares que na presença de água, sofrem ionização, formando cátion H+(hidrogênio) que se une à molécula de água formando o íons H3O+ (hidroxônio ou hidrônio). Desta forma, o exemplo anterior seria assim representado:
Ex.: HCl + H2O → H3O+(aq) + Cl-(aq)

Este site foi atualizado em 04/03/19