 ESTEQUIOMETRIA
ESTEQUIOMETRIA
1. ConceitoÉ o cálculo das quantidades de reagentes e/ou produtos das reações químicas em mols, em massa, em volume, número de átomos e moléculas, realizado como conseqüência da lei de Proust, executado, em geral, com auxílio das equações químicas correlatas.
A palavra estequiometria é de origem grega e significa medida de uma substância.
Estéquio: do grego Stoikheion (elemento ou substância)
Metria: do grego metron (medida)
2. A Importância
A estequiometria é de extrema importância no cotidiano, principalmente nas indústrias ou laboratórios, pois objetiva calcular teoricamente a quantidade de reagentes a ser usada em uma reação, prevendo a quantidade de produtos que será obtida em condições preestabelecidas.
3. Revendo Conceitos sobre Relações Básicas
Elementos
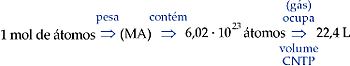
1 mol de átomos corresponde à massa atômica expressa em gramas, um número igual a 6,0 · 1023 átomos, que, se forem de um gás e estiverem nas CNTP, ocuparão um volume de 22,4 L.
Substâncias
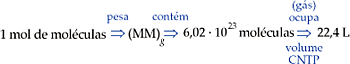
1 mol de moléculas corresponde à massa molecular expressa em gramas, um número igual a 6,02 · 1023 moléculas, que, se forem de um gás e estiverem nas CNTP, ocuparão um volume de 22,4 L.
4. Conduta de Resolução
Na estequiometria, os cálculos serão estabelecidos em função da lei de Proust e Gay-Lussac, neste caso para reações envolvendo gases e desde que estejam todos nas mesmas condições de pressão e temperatura.
Em seguida, devemos tomar os coeficientes da reação devidamente balanceados, e, a partir deles, estabelecer a proporção em mols dos elementos ou substâncias da reação.
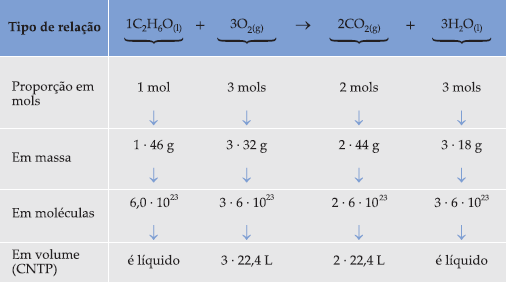
Como exemplo podemos citar a reação de combustão do álcool etílico:
C2H6O + O2 → CO2 + H2O
Balanceando a equação, ficamos com:
![]()
Estabelecida a proporção em mols, podemos fazer inúmeros cálculos, envolvendo os reagentes e/ou produtos dessa reação, combinando as relações de várias maneiras:
Para efetuarmos o cálculo estequiométrico, vamos obedecer à seguinte seqüência:
a) escrever a equação envolvida;
b) acertar os coeficientes da equação (ou equações);
Observação
Uma equação química só estará corretamente escrita após o acerto dos coeficientes, sendo que, após o acerto, ela apresenta significado quantitativo.
c) relacionar os coeficientes com mols. Teremos assim uma proporção inicial em mols;
d) estabelecer entre o dado e a pergunta do problema uma regra de três. Esta regra de três deve obedecer aos coeficientes da equação química e poderá ser estabelecida, a partir da proporção em mols, em função da massa, em volume, número de moléculas, entre outros, conforme dados do problema.
5. Tipos de Cálculos Estequiométricos
I. Relação Quantidade em Mols
Os dados do problema e as quantidades incógnitas pedidas são expressos em termos de quantidade em mols.
II. Relação entre Quantidade em Mols e Massa
Os dados do problema são expressos em termos de quantidade em mols (ou massa) e a quantidade incógnita é pedida em massa (ou quantidade em mols).
III. Relação entre Massa e Massa
Os dados do problema e as quantidades incógnitas pedidas são expressos em termos de massa.
IV. Relação Entre Massa e Volume
Os dados do problema são expressos em termos de massa e a quantidade incógnita é pedida em volume.
Caso o sistema não se encontrar nas CNTP, deve-se calcular a quantidade em mols do gás e, a seguir, através da equação de estado, determinar o volume correspondente. Por exemplo:
Calcular o volume de CO2 produzido numa temperatura de 27° e pressão de 1 atm, na reação de 16 g de oxigênio com monóxido de carbono.
Dado: constante universal dos gases - 0,082 atm · L · mol–1 · K–1
Resolução
![]()
1 · 32 g _________ 2 mols → relação do problema
16 g _________ n → dado e pergunta
n = 1,0 mol
Equação de estado: P · V = n · R · T → 1 · V = 1 · 0,082 · 300 → V = 24,6 L
V. Relação entre número de moléculas (átomos) e massa, quantidade em mols ou volume
Os dados do problema são expressos em termos de número de moléculas ou número de átomos e a quantidade incógnita é pedida em massa, quantidade em mols ou volume.
VI. Problemas Envolvendo mais de uma Reação
Neste caso, devemos escrever todas as reações envolvidas no problema e efetuar o balanceamento. Observa-se, neste caso, que é possível efetuar a soma algébrica dessas reações, bastando, para isso, multiplicar ou dividir as reações, a fim de cancelarmos as substâncias intermediárias e termos, então, uma única reação.
VII. Lei de Gay-Lussac (1808)
“Os volumes das substâncias gasosas participantes de uma reação química, estando nas mesmas condições de temperatura e pressão, guardam entre si uma relação constante de números inteiros e menores possíveis”.
VIII. Problemas Envolvendo Reagentes em Excesso
Quando o exercício fornece quantidades (massa, volume, mols, etc.) de dois reagentes, devemos verificar se existe excesso de algum reagente.
As quantidades de substâncias que participam da reação química são sempre proporcionais aos coeficientes da equação. Se a quantidade de reagente estiver fora da proporção indicada pelos coeficientes da equação, reagirá somente a parte que se encontra de acordo com a proporção; a parte que estiver a mais não reage e é considerada excesso.
IX. Sistema em os Reagentes São Substâncias Impuras
Neste caso é importante calcularmos a massa referente à parte pura, supondo que as impurezas não participam da reação.
Grau de pureza (p) é o quociente entre a massa da substância pura e a massa total da amostra (substância impura).
![]()
X. Sistema em que o Rendimento não é Total
Quando uma reação química não produz as quantidades de produto esperadas, de acordo com a proporção da reação química, dizemos que o rendimento não foi total.
Rendimento de uma reação é o quociente entre a quantidade de produto realmente obtida e a quantidade esperada, de acordo com a proporção da equação química.
Este site foi atualizado em 04/03/19