 REAÇÕES
REAÇÕES
|
O benzeno é uma molécula planar envolvida por duas "roscas"
de nuvens elétrons p,
abaixo e acima do plano do anel. Como consequência,
o benzeno é um nucleófilo,
e é facilmente atraído por um eletrófilo (Y+).
Quando um eletrófilo se liga ao benzeno, ocorre a formação
de um intermediário carbocátion. Este carbocátion poderia
reagir com um outro nucleófilo, mas neste caso o produto não
seria mais aromático. Como há uma grande estabilzação
energética associada a aromaticidade, o anel perde um próton
do sítio de ataque eletrófilo, e a aromaticidade é
restaurada. O resultado é a substituição de um hidrogênio,
do anel, por um eletrófilo.
 |
A reação do benzeno para formar um derivado de
substitutuição tem um
DGo
muito próximo a zero, enquanto que para formar um derivado
de adição não aromático é bastante endergônica.
Consequentemente, compostos aromáticos como
o benzeno ou derivados sofrem
reações de substituição eletrofílica (um
eletrólifo substitui um hidrogênio) mais facilmente do que
reações de adição eletrofílica. Exatamente o oposto que é
observado com os alcanos.
As cinco reações de
substituição eletrofílicas aromáticas mais comuns
são:
>Halogenação: um halogênio (Br, Cl ou I) substitui um
hidrogênio;
>Nitração: um grupo nitro (NO2)
substitui um hidrogênio;
>Sulfonação: um grupo de ácido sulfônico (SO3H)
substitui um hidrogênio;
>Acilação de Friedel-Crafts: um grupo acil
(RC=O) substitui um hidrogênio;
>Alquilação de Friedel-Crafts: um grupo alquil
(R) substitui um hidrogênio.
Todas estas reações parecem seguir o
mesmo mecanismo genérico.
Inicialmente, um par de elétrons do anel benzeno ataca um
eletrófilo (Y+), formando um
intermediário carbocátion. A estrutura do carbocátion pode
ser estabilizada por três contribuições ressonantes. No
segundo passo da reação, um próton do anel é atacado por um
nucleófilo do meio, e o elétron que ligava o próton ao anel
fica disponível para reestabelecer a aromaticidade.
 |
Mesmo sem olhar no diagrama de energia apresentado
anteriormente, podemos prever que o
primeiro passo é que é a
etapa lenta, determinante da velocidade da
reação: neste passo é que ocorre a perda da aromaticidade do
anel. O segundo passo deve ser rápido, pois devolve a
estabilidade ao composto. Nós iremos ver como este mecanismo
genérico de dois passos se aplica a todas as cinco
substituições eletrofílicas.
> Halogenação do Benzeno
Embora existam mais halogênios,
apenas 3 são capazes de
reagir como eletrófilos com o anel benzênico: o
cloro, o bromo e o iodo. Para a reação ocorrer, é necessário
a presença de um ácido de Lewis (FeCl3
ou FeBr3) como catalisador.
Lembre-se de que um ácido de Lewis é um composto que aceita
um par eletrônico. Na halogenação de alcenos, não é
necessário o uso de ácidos de Lewis, porque os alcenos são
nucleófilos mais fortes do que o benzeno.
Na bromação do benzeno, o primeiro passo ocorre quando
o bromo doa um par de
elétrons para o ácido de Lewis, enfraquecendo a
ligação Br-Br, e, então, providenciando o sítio eletrofílico
para a substituição. Em nome da simplicidade, o eletrófilo é
chamado de Br+; na verdade tal
espécie não existe, mas sim um complexo BrFeCl3Br.
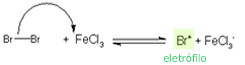 Como tanto o FeBr3
como o FeCl3 reagem
com a humidade do ar e se tornam inativos, eles
são gerados in situ.
Como tanto o FeBr3
como o FeCl3 reagem
com a humidade do ar e se tornam inativos, eles
são gerados in situ.
Para tanto, adiciona-se limalha de ferro à
mistura reacional.
2 Fe + 3 Br2 2
FeBr3 2
FeBr3
|
A cloração do benzeno ocorre pelo mesmo mecanismo que a
bromação. Já o iodo eletrófilo (I+)
é obtido pela oxidação do
I2 com um agente
oxidante, tal como o ácido nítrico.
> Nitração do Benzeno
A nitração do benzeno requer o ácido sulfúrico como um
catalisador - ele protona o ácido nítrico, que, perdendo
água, gera o íon nitrônio, o eletrófilo requerido para a
nitração. Uma base qualquer (B = H2O,
HSO4-)
presente na mistura reacional pode remover o próton do anel,
no segundo passo da substituição aromática. O mecanismo da
substituição é o mesmo da halogenação.
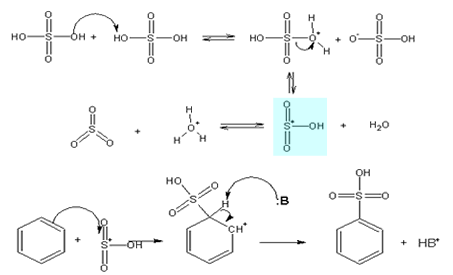
> Sulfonação do Benzeno
A preparação do ácido benzenossulfônico envolve a adição de
uma solução concentrada de ácido sulfúrico ou, ainda, uma
solução fumegante (SO3
dissolvido em H2SO4),
para sulfonar o anel. A
vantagem de se utilizar o SO3
como reagente pode ser observada no equilíbrio
abaixo: a população do eletrófilo +SO3H
é aumentada na solução reacional.
 |
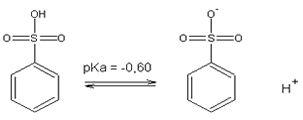 Os
ácidos sulfônicos são ácidos fortes. Isto se deve
a forte estabilização de sua base conjugada. O íon tem 3
oxigênios que podem exibir ressonância e estabilizar a
carga. A sulfonação do benzeno é uma reação reversível; se o
ácido benzenossulfônico é aquecido em uma solução ácida,
ocorre a reação de substituição reversa, isto é, o
hidrogênio toma o lugar do grupo SO3. Os
ácidos sulfônicos são ácidos fortes. Isto se deve
a forte estabilização de sua base conjugada. O íon tem 3
oxigênios que podem exibir ressonância e estabilizar a
carga. A sulfonação do benzeno é uma reação reversível; se o
ácido benzenossulfônico é aquecido em uma solução ácida,
ocorre a reação de substituição reversa, isto é, o
hidrogênio toma o lugar do grupo SO3.
> Acilação de Friedel-Crafts
Muitas reações levam o nome do químico responsável pela sua
discoberta. A acilação e a alquilação de Friedel-Crafts
levam os nomes de dois cientistas, que desenvolveram estes
importantes processos reacionais, contribuindo em muito para
a síntese orgânica. Isto ocorreu em 1877, no laboratório de
Charles Friedel.
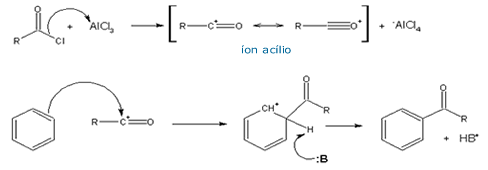 |
Na acilação de Friedel-Crafts,
um grupo acila (RC=O)
substitui um hidrogênio no anel benzênico. Para
tanto, é necessário se aumentar a eletrofilicidade do
carbono carbonílico. Tanto um haleto de acila ou um anidrido
ácido podem ser usados para este fim. Novamente, se faz
necessário um ácido de Lewis como catalisador; neste caso,
Friedel e Crafts descobriram que o melhor era a base de
alumínio, o AlCl3. Este aceita um
par de elétrons do haleto ou do anidrido, liberando o grupo
acila eletrofílico (íon acílio).
> Alquilação de Friedel-Crafts
Tanto a acilação como a alquilação de Friedel-Crafts
envolvem o uso do AlCl3 como
ativador do eletrófilo. No caso da alquilação,
o eletrófilo é um carbocátion
(R+). No primeiro passo, o
carbocátion é formado pela reação de um cloreto de alquila
com o ácido de Lewis. Outros haletos de alquila, como
brometos, fluretos ou iodetos, também podem ser utilizados.
Haletos de vinila ou de arila não funcionam, pois seus
carbocátions são muito instáveis.
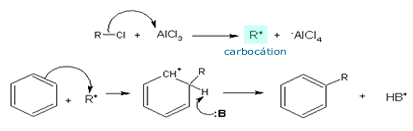 |
O produto da reação - um alquilbenzeno - é mais reativo do
que o próprio benzeno. Para evitar a alquilação de um
benzeno já alquilado, então, utiliza-se um
excesso de benzeno na reação. Neste caso, o
carbocátion tem mais chance de encontrar uma molécula de
benzeno não-substituído, e formam-se, preferencialmente,
apenas benzenos mono-substituídos.
Os carbocátios podem
sofrer rearranjos antes da reação com o anel
aromático; muitas vezes, obtém-se misturas de isômeros
alquil-benzeno. O rearranjo ocorre na direção do carbocátion
mais estável - uma regra geral é a de que quanto mais
substituído for o carbono, mais estável é o carbocátion. As
quantidades relativas dos isômeros formados depende da
estabilidade alcançada com o rearranjo.
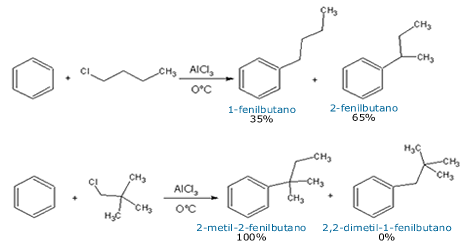 Na alquilação, os carbocátions sofrem rearranjos
para aumentar sua estabilidade
Na alquilação, os carbocátions sofrem rearranjos
para aumentar sua estabilidade
|
Na reação do benzeno com 1-clorobutano, por exemplo, o
rearranjo pode converter um carbocátion primário em um
secundário (mais estável). Nesta reação, o produto mais
formado (65%) é o 2-fenilbutano. Na reação com do benzeno
com o 1-cloro-2,2-dimetilpropano, uma grande estabilidade é
alcançada com o rearranjo em direção ao
carbocátion terciário,
e 100% do produto refere-se ao substituinte alquila
rearranjado.

Reações
com derivados do benzeno
Vimos, até agora, como obter vários benzenos substituídos.
Nesta etapa, veremos
reações envolvendo os derivados do benzeno.
Muitas vezes, para se obter um determinado composto, é
necessário se preparar um derivado da maneira como vimos
anteriormente e, após, modificar quimicamente este
substituinte. Os substituintes, entretanto, exercem efeitos
sobre a reatividade do benzeno. Veremos, também, os efeitos
provocados por estes substituintes e as consequências sobre
as reações envolvendo o anel.
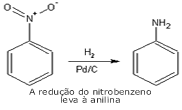 Digamos
que quiséssemos, por exemplo, obter a
anilina, partindo do benzeno.
Nas reações vistas anteriormente, nenhuma indica a
substituição de um hidrogênio por um grupo amino. Temos,
então, que utilizar outra estratégia. A mais simples parece
ser a preparação do nitrobenzeno seguida da redução do grupo
nitro, que gera o grupo amino - portanto, a anilina. Para
fazer esta redução é necessário o uso de um sistema redutor.
Os mais utilizados são a bases de metais, tal como Pd/C ou
Sn/HCl. No segundo caso, forma-se a anilina protonada (íon
anilínio), que pode ser neutralizada com uma base. Seguindo
a mesma analogia, a anilina pode ser oxidada - para o
nitrobenzeno. Digamos
que quiséssemos, por exemplo, obter a
anilina, partindo do benzeno.
Nas reações vistas anteriormente, nenhuma indica a
substituição de um hidrogênio por um grupo amino. Temos,
então, que utilizar outra estratégia. A mais simples parece
ser a preparação do nitrobenzeno seguida da redução do grupo
nitro, que gera o grupo amino - portanto, a anilina. Para
fazer esta redução é necessário o uso de um sistema redutor.
Os mais utilizados são a bases de metais, tal como Pd/C ou
Sn/HCl. No segundo caso, forma-se a anilina protonada (íon
anilínio), que pode ser neutralizada com uma base. Seguindo
a mesma analogia, a anilina pode ser oxidada - para o
nitrobenzeno.
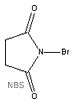 Um
reagente muito versátil na síntese orgânica, envolvendo
derivados do benzeno, é o
NBS (N-bromosuccinimida). Com este reagente, é
possível seletivamente substituir um hidrogênio na posição
benzílica por um bromo. Uma vez que o bromo esteja nesta
posição, é possível se obter uma série de outros compostos,
por substituições nucleofílicas via SN1
ou SN2. Os químicos sintéticos
obtém muitos compostos orgânicos desta forma, incluindo
álcoois, aminas, acetonitrilas, entre outros. O esquema
abaixo ilustra algumas reações possíveis com o brometo de
benzila - que pode ser obtido através da reação do tolueno
com o NBS. Um
reagente muito versátil na síntese orgânica, envolvendo
derivados do benzeno, é o
NBS (N-bromosuccinimida). Com este reagente, é
possível seletivamente substituir um hidrogênio na posição
benzílica por um bromo. Uma vez que o bromo esteja nesta
posição, é possível se obter uma série de outros compostos,
por substituições nucleofílicas via SN1
ou SN2. Os químicos sintéticos
obtém muitos compostos orgânicos desta forma, incluindo
álcoois, aminas, acetonitrilas, entre outros. O esquema
abaixo ilustra algumas reações possíveis com o brometo de
benzila - que pode ser obtido através da reação do tolueno
com o NBS.
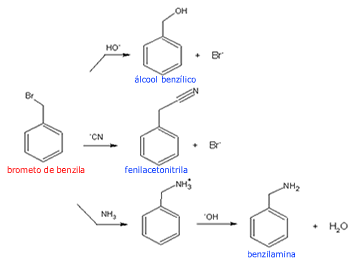 Reações com um derivado obtido via NBS
Reações com um derivado obtido via NBS
|
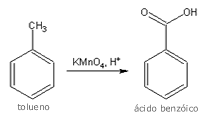 O
anel benzeno não pode ser oxidado; entretanto,
vários de seus derivados
podem sofrer oxidação. Uma das oxidações mais
clássicas é a do tolueno, que pode ser oxidado para um ácido
carboxílico - no caso, o ácido benzóico. A reação pode ser
feita com soluções ácidas de dicromato de sódio ou
permanganato de potássio. Como a reação de oxidação envolve
a remoção de hidrogênios do grupo alquila, um carbono
terciário, tal como o tert-butilbenzeno, não sofre oxidação.
Independentemente do tamanho do grupo alquila ligado ao
anel, o composto sempre será oxidado no sentido de
substituir os hidrogênios benzílicos, isto é, formando o
ácido benzóico (ou derivados). O
anel benzeno não pode ser oxidado; entretanto,
vários de seus derivados
podem sofrer oxidação. Uma das oxidações mais
clássicas é a do tolueno, que pode ser oxidado para um ácido
carboxílico - no caso, o ácido benzóico. A reação pode ser
feita com soluções ácidas de dicromato de sódio ou
permanganato de potássio. Como a reação de oxidação envolve
a remoção de hidrogênios do grupo alquila, um carbono
terciário, tal como o tert-butilbenzeno, não sofre oxidação.
Independentemente do tamanho do grupo alquila ligado ao
anel, o composto sempre será oxidado no sentido de
substituir os hidrogênios benzílicos, isto é, formando o
ácido benzóico (ou derivados).
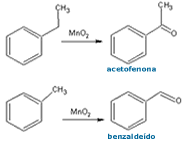 Vimos
como obter um ácido carboxílico a partir de um alquil-fenol.
Mas o que fazer se quisermos obter uma cetona ou um aldeído?
Estes grupos funcionais caracterizam-se por um carbono sp2
ligado a apenas 1 oxigênio, via ligação dupla. É um estado
de oxidação anterior ao do ácido carboxílico. Neste caso,
para conseguir a cetona,
deve-se utilizar um agente oxidante mais brando; assim, o
carbono benzílico é somente parcialmente oxidado, resultando
numa cetona, ou em um aldeído, caso o substituinte for o
metil. Este é um método utilizado para se obter a
acetofenona e o benzaldeído, por exemplo. Ambos compostos
são muito utilizados pelos químicos, na síntese orgânica. Vimos
como obter um ácido carboxílico a partir de um alquil-fenol.
Mas o que fazer se quisermos obter uma cetona ou um aldeído?
Estes grupos funcionais caracterizam-se por um carbono sp2
ligado a apenas 1 oxigênio, via ligação dupla. É um estado
de oxidação anterior ao do ácido carboxílico. Neste caso,
para conseguir a cetona,
deve-se utilizar um agente oxidante mais brando; assim, o
carbono benzílico é somente parcialmente oxidado, resultando
numa cetona, ou em um aldeído, caso o substituinte for o
metil. Este é um método utilizado para se obter a
acetofenona e o benzaldeído, por exemplo. Ambos compostos
são muito utilizados pelos químicos, na síntese orgânica.
|
Cuidado!!!
Veneno!!!
|
 Embora
muito utilizado na síntese orgânica e
frequentemente usado como solvente, o benzeno é
muito tóxico. Seus maiores danos são no SNC e no
tecido ósseo. A exposição crônica ao benzeno
causa anemia e leucemia. Vários relatos de
operários de indústrias químicas que contraíram
leucemia existem na literatura médica. Uma
concentração de apenas 1 ppm na atmosfera já
representa um alto fator de risco. Por isso,
muitas vezes os químicos optam pelo tolueno,
como solvente; vários produtos que tinham
benzeno passaram a utilizar o tolueno. Embora
também cause danos no SNC, não provoca anemia ou
leucemia. Os "cheiradores de cola" buscam
justamente os efeitos no SNC do tolueno quando
utilizam a cola. Esta é uma atividade
extremamente prejudicial... Embora
muito utilizado na síntese orgânica e
frequentemente usado como solvente, o benzeno é
muito tóxico. Seus maiores danos são no SNC e no
tecido ósseo. A exposição crônica ao benzeno
causa anemia e leucemia. Vários relatos de
operários de indústrias químicas que contraíram
leucemia existem na literatura médica. Uma
concentração de apenas 1 ppm na atmosfera já
representa um alto fator de risco. Por isso,
muitas vezes os químicos optam pelo tolueno,
como solvente; vários produtos que tinham
benzeno passaram a utilizar o tolueno. Embora
também cause danos no SNC, não provoca anemia ou
leucemia. Os "cheiradores de cola" buscam
justamente os efeitos no SNC do tolueno quando
utilizam a cola. Esta é uma atividade
extremamente prejudicial...
|
|
|