CREME DENTAL
CREME DENTAL

O esmalte que cobre os dentes contém o mineral hidroxiapatita:
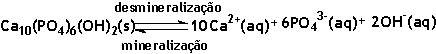
equilíbrio I
A formação da cárie dentária deve-se ao fato, do consumo de alimentos adocicados, onde o açúcar em presença das bactérias da saliva, sofre uma fermentação produzindo vários ácidos dentre os quais destaca-se o ácido láctico.
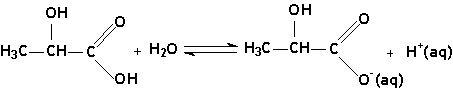
equilíbrio II
Os íons H+ do ácido láctico (equilíbrio II), consomem os íons OH- do equilíbrio I, deslocando-o para a direita, prevalecendo a desmineralização do esmalte, originando a cárie.
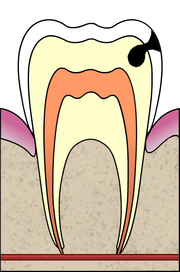
Exemplo de lesão cariosa atingindo a camada de dentina
Como vimos, a hidrólise do bicarbonato origina íons OH-.
NaHCO3+ HOH → NaOH + <H2CO3>
Na+ + HCO3- + H2O → Na+ + OH- + H2O + CO2
HCO3- → OH- + CO2
Os íons OH- do bicarbonato de sódio consomem os íons H+ do ácido Láctico neutralizando-o, e também aumentam a concentração dos íons OH- do equilíbrio II, deslocando-o para a esquerda, prevalencendo a mineralização do esmalte, prevenindo desta forma a formação da cárie.
Este site foi atualizado em 11/03/09