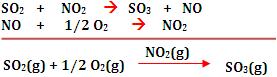



|
|
Cinética
química
- Velocidade de reação
-
Classificação das reações quanto a velocidade
- Condições
necessárias para ocorrer uma reação química
- Energia de ativação
- Teoria da colisão
- Lei da velocidade de reação
- Fatores que
modificam a Velocidade da Reação
- Catálise e catalisador
- Enzima
- Autocatálise

| vmédia de formação de C = |
D[C]
———
Dt |
|
| vmédia de consumo de A = |
-D[A]
———
Dt |
|
| vmédia da reação = |
-D[A]
———
a·Dt |
= |
-D[B]
———
b·Dt |
= |
-D[C]
———
c·Dt |
= |
-D[D]
———
d·Dt |
|
Velocidade ou rapidez de uma reação
A velocidade de uma reação química é definida como a
relação entre a quantidade consumida
ou produzida e o intervalo
de tempo utilizado para que isso aconteça.

Geralmente, essas quantidades são expressas em
mols. A medida do tempo também pode ser pronunciada
em qualquer unidade que esteja de acordo com a
reação:
A expressão abaixo pode ser utilizada para calcular
a velocidade de uma reação:
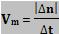
Onde:
Vm é a velocidade média da reação.
∆n é a variação da quantidade em mols de um
componente (em módulo).
∆t é o tempo gasto em tal variação.
Exemplo:
Seja a reação A + B ® C +
D, efetuando-se num sistema fechado. Vamos
determinar a quantidade em mols de C em dois
instantes:
t1 = 10min ® n1
= 2 mol
t2 = 20min ® n2
= 3 mol
A velocidade média será:
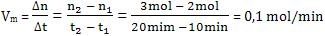
A cada minuto forma-se uma média de 0,1 mol de C.
Podemos utilizar várias grandezas para calcular a
velocidade média ou rapidez da reação:

Gráfico de
velocidade de uma reação
Podemos obter alguns tipos de gráficos quando
estudamos a variação da concentração de reagentes,
produtos e velocidades, numa reação química. Porém,
a compreensão desses gráficos deve ser feita de uma
forma geral.
Veja abaixo, de um modo geral, três tipos de
gráfico:
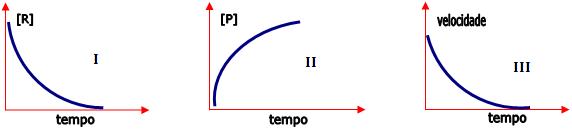
I – Concentração dos reagentes diminuem com o tempo.
II – Concentração dos produtos aumentam com o tempo.
III – Velocidade diminui, pois (v = K. [R])
Classificação das reações quanto à velocidade
Reações instantâneas
São aquelas reações que ocorrem numa velocidade muito elevada,
dificultando a sua determinação. Como exemplo, podemos citar as
reações explosivas, reações de precipitação, reações de
neutralização de ácido por base, entre outras.
Reações lentas
São as reações que ocorrem numa velocidade muito baixa.
Exemplo:
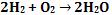
(em condições ambientes, sem a presença de fatores externos)
Reações moderadas
São aquelas velocidade que ocorrem numa velocidade
intermediária. A Cinética Química interessa-se principalmente
por este tipo de reação, pois a sua velocidade pode ser medida
com exatidão.
Exemplo:
- Reações de metais, não muito reativos, com ácidos:

Normalmente, as reações entre compostos inorgânicos são rápidas
e as reações entre compostos orgânicos são lentas.
Condições
para que uma reação ocorra
Condições fundamentais
As condições fundamentais para que ocorra uma reação
são:
1. Afinidade química:
Os reagentes devem ter tendência ao entrar em reação.
2. Contato entre os reagentes:
A fim de que possa haver interação química.
Condições acessórias
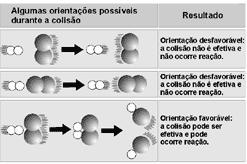
Deve haver colisão entre as partículas ativadas
energeticamente e ocorrer um choque bem orientado.
Complexo ativado é uma estrutura intermediária
entre os reagentes e os produtos, com ligações intermediárias entre as dos
reagentes e as dos produtos.
A energia de ativação pode ser
definida como uma barreira energética, que impede a ocorrência
da reação, ou ainda, é a energia mínima necessária para a
formação do complexo ativado. A reação só ocorre quando essa
barreira for superada.
Portanto, quanto maior a energia de ativação, mais difícil será
para ocorrer a reação. Assim, as reações lentas necessitam de
grande quantidade de energia para ocorrer.
E quanto menor a energia de ativação mais fácil será para
ocorrer a reação. Desse modo, as reações rápidas necessitam de
pouca energia para ocorrer.

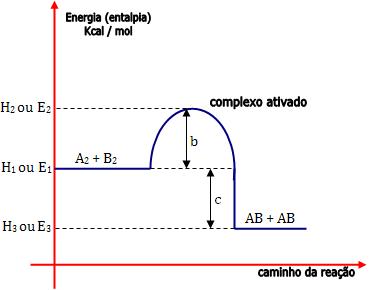
Análise gráfica da energia de ativação
• Reação exotérmica
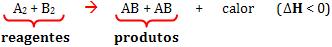
Graficamente, temos:
Onde:
E1 = energia própria dos reagentes
E2 = energia do complexo ativado
b = energia de ativação da reação direta R ®
P (E2 – E1)
b + c = energia de ativação da reação inversa P
® R (E2 – E3)
c = ∆H (variação de entalpia) da reação (variação total da
energia).
E3 = energia própria dos produtos
Note que E2 – E3 (b + c) > E2 –
E1 (b).
• Reação endotérmica

Graficamente, temos:
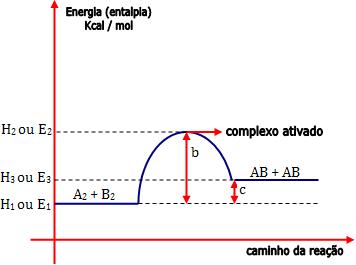
Onde:
E1 = energia própria dos reagentes
E2 = energia do complexo ativado
b = energia de ativação da reação direta (R
® P)
b - c = energia de ativação da reação inversa (P
® R)
c = ∆H (variação de entalpia) da reação (variação total da
energia).
E3 = energia própria dos produtos
Note que E2 – E3 (b – c) < E2 –
E1 (b).
O ponto mais elevado do gráfico refere-se ao momento da colisão
entre as partículas ativadas.
Pela teoria da colisão, para haver reação é
necessário que:
 |
as moléculas dos reagentes colidam entre si;
|
 |
a colisão ocorra com geometria favorável à formação
do complexo ativado;
|
 |
a energia das moléculas que colidem entre si seja
igual ou superior à energia de ativação. |
Colisão efetiva ou eficaz é aquela que
resulta em reação, isto é, que está de acordo com as duas últimas condições
da teoria da colisão. O número de colisões efetivas ou eficazes é muito
pequeno comparado ao número total de colisões que ocorrem entre as moléculas
dos reagentes.
Quanto menor for a energia de ativação de uma reação,
maior será sua velocidade.
Uma elevação da temperatura aumenta a velocidade de uma
reação porque aumenta o número de moléculas dos reagentes com energia
superior à de ativação.
|
aA
+ bB + ...
® produtos |
v = k [A]p
[B]q |
 |
p e q são experimentalmente
determinados
|
 |
k = constante de velocidade de reação; aumenta
com a temperatura
|
 |
p = ordem da reação em relação a
A
|
 |
q = ordem da reação em relação a
B
|
 |
p + q + ... = ordem da reação |
Reagente(s) gasoso(s)
- A pressão de um gás é diretamente proporcional à
sua concentração em mol/L. Por isso, no caso de reagente(s) gasoso(s), a lei
de velocidade pode ser expressa em termos de pressão.
Para aA(g) + bB(g) + ...
®
produtos, temos: v = k·ppA·pqB
O aumento da pressão aumenta a velocidade da reação.
Quando não há reagente gasoso, a pressão não influi na velocidade da reação.
Determinação experimental da
equação da velocidade da reação
Para escolher uma equação matemática, que represente a variação
da velocidade da reação com a concentração dos reagentes,
devemos nos basear apenas nos dados experimentais.
Exemplo:
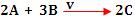
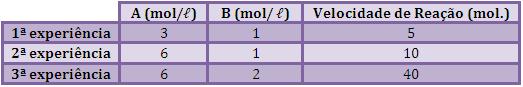
Podemos observar na tabela abaixo, a variação da velocidade com
as concentrações, obtida por experiência:
Para determinar, experimentalmente, a equação
da velocidade, devemos variar a concentração molar dos reagentes
e verificar como varia a velocidade.
v = k [A]x [B]x
Sendo
que x e y serão determinados.
Dois métodos podem ser usados:
1. Método comparativo
Ao comparar a 1ª e a 2ª experiência, percebe-se que a
concentração de B é a mesma, já a concentração de A dobrou, e
conseqüentemente a velocidade também dobrou.
Ao comparar a 2ª e a 3ª experiência, notamos que a concentração
de A é permaneceu constante, já a concentração de B dobrou e
conseqüentemente a velocidade quadriplicou.
Concluímos, então, que a velocidade varia com a 1ª potencia de
[A] e com a 2ª potencia de [B].
v = k . [B]1
. [B]2
2. Método Algébrico
Primeiramente, dividimos v1 por v2:
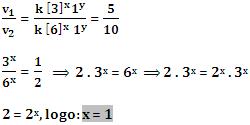
Em seguida, dividimos v2 por v3
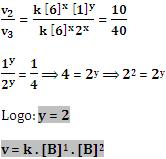
Reação elementar é aquela que ocorre numa única
etapa. Neste caso, para
aA + bB + ... ®
produtos,
temos:
v = k [A]a [B]b...
Molecularidade de uma reação - é o
número total de partículas que se colidem para constituir o complexo
ativado. Sendo assim, a molecularidade só pode ser definida em cada etapa da
reação, pois cada etapa tem o seu complexo ativado e a sua molecularidade.
Mecanismo de reação é o conjunto das etapas em que
ocorre a reação. A etapa lenta é a que determina a velocidade da reação. O
mecanismo de uma reação é proposto com base no estudo de sua velocidade.
Superfície de contato - Quanto maior for o grau de dispersão de um
sólido, maior será a sua superfície e maior será a velocidade da reação na
qual é reagente.
Ordem de uma reação - é definida como
a soma dos expoentes de concentração, que se apresentam na Lei
Experimental da Velocidade.
Seja a reação:
2 H2
+ 2 NO ®
N2 + 2 H2O
Onde a lei experimental da velocidade é:
v = k [H2]1
[NO]2
Portanto esta reação é de 3ª ordem.
Nota: Não esqueça que a lei de Guldberg
Waage aplicada à reação global nem sempre é a Lei Experimental
da Velocidade, esta refere-se certamente à velocidade da etapa
lenta da reação, ou seja, a etapa determinante da velocidade da
reação.
Rapidez da
transformação e concentração
Seja a reação de zinco com ácido clorídrico liberando gás
hidrogênio:
Zn(s) + 2HCl(aq)
®
ZnCl2(aq) + H2(g)
Com a decorrência do tempo, a concentração de
HCl vai se reduzindo, assim como no gráfico:
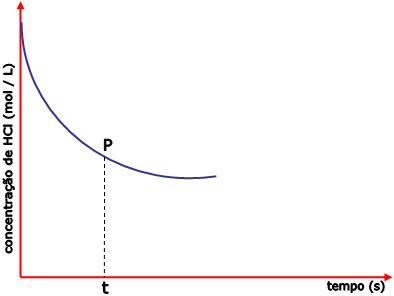
Vamos calcular a velocidade da reação no
instante t:
- Trace uma tangente à curva pelo ponto P.
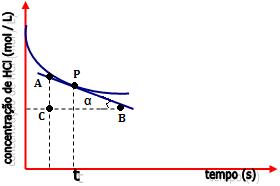
Selecione, sobre a tangente, dois pontos A e
B. No triângulo retângulo ABC, a tangente trigonométrica do
ângulo α é dada por:

A tangente do ângulo α pronuncia a velocidade
da reação no instante t.
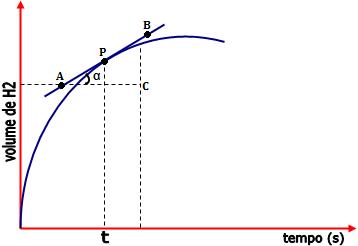
À medida que decorre o tempo, o volume de H2 formado
aumenta. Podemos calcular através do mesmo processo, a
velocidade no instante t em termos de variação do volume H2
formado com o tempo.
Fatores que modificam
a Velocidade da Reação
Natureza de reagentes e produtos
Quanto maior o n.° de ligações a serem rompidas nos reagentes e quanto mais
fortes forem essas ligações, mais lenta será a reação, e vice-versa.
2NO + O2®
2NO2 (reação moderada a 20°C).
CH4 + 2O2 ® CO2
+ 2H2O (muito lenta 20°C).
Luz
Acelera reações fotoquímicas.
no escuro
Ex.: H2(g) + Cl2(g) ® 2HCl(g)
(reação muito lenta)
Luz
H2(g) + Cl2(g) ® 2HCl(g)
(reação Rápida)
Pressão
O aumento da pressão num sistema que contém pelo menos um
participante gasoso, implica em diminuir o volume do sistema, aumentando o
n.° de colisões entre os reagentes e, conseqüentemente, a velocidade da
reação.

Temperatura
O aumento da temperatura faz aumentar a agitação molecular, a energia
cinética, o número de partículas com energia maior ou igual à energia de
ativação, o número de choques, aumentado a velocidade da reação.
Observação: O aumento da temperatura, aumenta a velocidade de reações
endotérmicas e exotérmicas.
Análise gráfica da
influência da temperatura na velocidade de uma reação
Vamos representar graficamente a influência da temperatura na
velocidade da reação. O gráfico abaixo mostra a distribuição de
energias das partículas sob duas temperaturas diferentes.
À temperatura T1, algumas partículas possuem energia
muito baixa e outras partículas apresentam energia muito alta,
porém a grande maioria apresenta energia intermediária. À
temperatura T2 há uma alteração na distribuição de
energia, podemos notar que a elevação da temperatura causou um
deslocamento geral na distribuição, para as energias mais altas.
Tais curvas podem ser impostas à velocidade da reação.
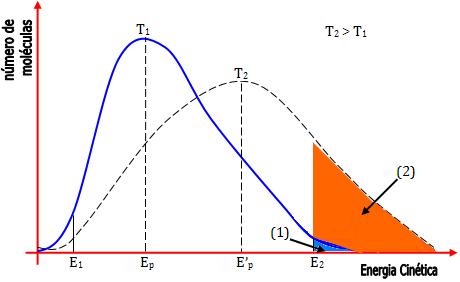
Sendo a energia Emin = E1 é menor que a
energia própria Ep das partículas reagentes, uma
grande quantidade de partículas terá condições de reagir sob
temperatura T1, aumentado a velocidade da reação. Já
se a energia mínima necessária para que ocorra a reação for Emin
= E2 só algumas partículas distribuídas à direita da
curva, na área (1), terão condições de reagir, sendo assim a
reação será lenta sob temperatura T1. No entanto, sob
temperatura T2, uma maior quantidade de partículas
terá condições de reagir, de modo que, a mesma reação é mais
rápida sob temperatura T2.
Regra de van't Hoff
- Uma elevação de 10°C duplica a velocidade de uma
reação.
Esta é uma regra aproximada e muito limitada.
Superfície de contato
Ao diluir uma barra de zinco numa solução líquida de ácido
clorídrico, ocorre a seguinte reação:
Zn(s) + 2HCl(aq)
® ZnCl2(aq)
+ H2(g)
Se caso tivéssemos pulverizado o zinco, a
reação seria mais rápida, pois ao reduzir o zinco a pó
facilitamos o ataque do ácido clorídrico. Ao pulverizar o zinco,
estamos ampliando a sua superfície de contato, conseqüentemente
aumentando a velocidade da reação.
Catálise é o nome de uma reação da qual o
catalisador participa.
Catalisador é uma substância que aumenta a velocidade da reação
porque diminui a energia de ativação necessária para que os
reagentes se transformem no complexo ativado.
Observação – Podem participar de uma
etapa da reação, porém são totalmente restituídos no fim da
mesma.
Algumas substâncias retardam a reação química, tais substâncias
são chamadas de inibidores ou
catalisadores negativos.
Exemplos de catálise
1º exemplo
Reação de decomposição da água oxigenada catalisada pelo
hidróxido.

2º exemplo
A reação da síntese de amônia sendo catalisada pelo ferro.
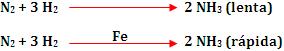
Mecanismo energético
do catalisador
O catalisador atua facilitando o caminho da reação, tornando-a
mais rápida. Ou seja, caminho que o catalisador oferece para a
reação apresenta menor energia de ativação.
Quando uma reação é catalisada, ocorre uma alteração no
mecanismo desta reação. Uma vez que a velocidade da reação
aumenta, a energia de ativação do novo caminho será menor que a
do caminho anterior, sendo assim, mais partículas por segundo
podem atingir o ponto mais alto, o complexo ativado se formará
mais rapidamente e a reação se desenvolverá com mais velocidade.
Veja abaixo uma reação catalisada:
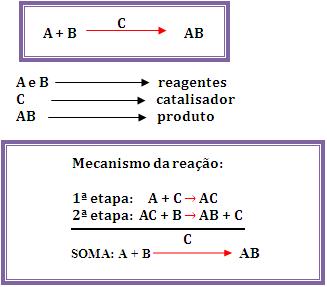
Percebe-se que o catalisador (C) fez parte da
1ª etapa da reação, porém na 2ª etapa foi regenerado. Não passou
por nenhuma alteração química permanente, nem de quantidade.
Também fez parte de uma etapa intermediária da reação.
Possibilitou que a reação fosse realizada em novas etapas, que
foram mais rápidas e que não aconteceriam sem a presença do
catalisador.
 |
Catálise homogênea - é uma reação cujo
catalisador e os reagentes constituem um sistema monofásico, ou seja, é
uma mistura homogênea. |
Exemplo:
Através do oxigênio (gás), o dióxido de nitrogênio (gás)
catalisa a oxidação do dióxido de enxofre (gás) a trióxido de
enxofre (gás).
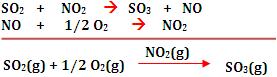
 |
Catálise heterogênea -é uma reação cujo
catalisador e os reagentes constituem um sistema polifásico, ou seja, é
uma mistura heterogênea. |
Exemplo:
A reação entre o hidrogênio (gás) e o etileno (gás) forma-se
o etano, sob a ação catalítica de alguns metais sólidos, como a
platina e o níquel.
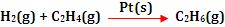
Aplicação de uma catálise: O buraco na
camada de ozônio
O ozônio (O3) presente
na alta atmosfera é constituído por um sistema em
duas etapas:
- As moléculas de O2 se dissociam.
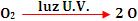
- O choque entre um átomo O com
uma molécula O2.

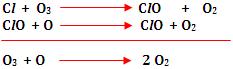
A decomposição do ozônio ocorre
da seguinte maneira:

Esse tipo de reação é lenta,
porém sua velocidade pode aumentar com influência de
diversos catalisadores, como átomos Cl.
Os compostos constituídos por
cloro, flúor e carbono, conhecidos por emitir o
clorofluorcarbono (CFC), são fontes de átomos de
cloro. Como exemplo temos os compostos CFCl3
e CF2Cl2 que são
usados como gases refrigerantes e propelentes de
aerossóis. Sob uma altura de 30 a 40Km a radiação
ultravioleta decompõem esses compostos liberando o
átomo de cloro:

O ozônio é muito importante na
alta atmosfera, pois esse gás possui a capacidade de
absorver luz ultravioleta. A sua destruição aumenta
a incidência de câncer de pele.
Ativadores
(promotores) de catalisador
Os ativadores são substâncias que atuam aumentando a eficácia do
catalisador. Sozinhos, os ativadores não são capazes de
catalisar uma reação.
Exemplo:
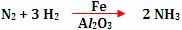
Fe = catalisador da reação
Al2O3 = ativador do catalisador
As substâncias que reduzem a ação do catalisador são denominadas
venenos de catalisador.
Enzima é uma proteína que atua como catalisador em
reações biológicas. Caracteriza-se pela sua ação específica e pela sua
grande atividade catalítica. Apresenta uma temperatura ótima,
geralmente ao redor de 37°C, na qual tem o máximo de atividade catalítica.
Promotor de reação ou ativador de catalisador é
uma substância que ativa o catalisador, mais isoladamente não tem ação
catalítica na reação.
Veneno de catalisador ou inibidor - o inibidor é o
oposto do catalisador, pois ele aumenta a energia de ativação e
conseqüentemente reduz a velocidade da reação. Essa substância reduz e até
destrói a ação do catalisador.
Exemplo:
A velocidade da decomposição da água oxigenada é reduzida pelo
meio ácido (H+).
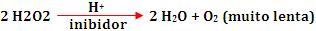
O ácido entra em reação com as impurezas que
estão na água oxigenada. Tais impurezas são eliminadas com a
reação, e sem elas a decomposição da água oxigenada não é
catalisada, portanto a decomposição torna-se mais lenta.
Autocálise é uma reação na qual um dos
produtos da reação atua como catalisador da própria reação.
Inicialmente, a reação é lenta, e conforme o catalisador
(produto) vai se constituindo, a velocidade vai se elevando.
Exemplo:
Seja a reação:
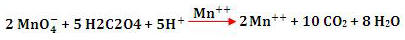
Mn++ é um produto autocatalisador, pois ele
aumenta a velocidade da própria reação em que é formado.
Home | Cinética Química | Eletroquímica | Equilíbrio Químico | Termoquímica | Propriedades Coligativas | Soluções
Este site foi atualizado em
04/03/19
|