PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
A Química na cozinha: FRUTAS E FRUTOS
Introdução
Cita, uma das reencarnações da deusa hindu Lahkmi,
casou com o príncipe Rama, uma reencarnação do deus Vishnu, e foi morar
com ele na cidade de Ayodhya. Ela levou presentes para os parentes de
seu marido que agradaram a todos, menos às suas sogras. Elas reclamavam
que nada era realmente exótico, ou raro. Sita, entristecida, pediu então
ajuda à sua família para encontrar algo tão extraordinário que agradasse
a todas elas. Sua mãe, desesperada, sentou-se embaixo de uma mangueira e
chorou copiosamente. Uma pequena ave negra, o koel, que tem o canto mais
belo de toda a Índia, perguntou à rainha o porquê daquele pranto. Ao
saber o motivo de seu desespero, a pequena ave voou até o topo da
mangueira e começou a cantar dia e noite, sem parar. Em poucos dias a
mangueira respondeu ao seu canto, brotando flores de uma fragrância
inebriante. Essas flores se transformaram em mangas douradas e maduras,
mas a esta altura o pequeno pássaro, que não parara de cantar, desmaiou
de cansaço. A família de Sita colheu as mangas e as enviou para as
sogras da princesa, que ficaram encantadas com aquela fruta perfeita,
jamais vista antes! Enquanto isto, o pequeno koel se recuperou de seu
descanso e acordou, mas ao ver que não havia uma única manga na árvore,
recomeçou a cantar com a mesma paixão, reiniciando um ciclo que perdura
até hoje: toda vez que o koel canta, a mangueira floresce, mas devido à
exaustão causada por seu canto delirante, ele nunca consegue provar a
manga madura. Fruta é um termo comumente empregado para designar frutos comestíveis de diversas plantas, embora haja frutas que não são frutos verdadeiros, como o figo, o abacaxi e o morango; também há frutos que são denominados legumes, como a abóbora, o tomate e o quiabo. Frutos são estruturas derivadas dos ovários depois da fecundação (pericarpo) e têm como função a proteção para as sementes (endocarpo) até sua maturação. Os frutos possuem diversas adaptações evolutivas para facilitar sua disseminação, como cores brilhantes e odores atraentes para os animais, alas para permitir o vôo ou espinhos para a fixação em aves e mamíferos.  Figo, abóbora e castanha Diversas frutas possuem odores muito marcantes, como a manga, a banana, o abacaxi e o morango. O odor dessas frutas se deve à presença de ésteres voláteis:
O acetato de isoamila, principal componente do odor da banana, também é empregado como diluente e removedor de esmalte de unhas e para a preparação de têmpera ovo para a pintura de quadros. Apesar de seu odor agradável para os mamíferos, é um dos compostos liberados pelas abelhas durantes seus ataques, atuando como um feromônio de alerta que mobiliza as abelhas presentes na área para se unirem nas ferroadas ao “invasor”, que pode ser você! Além disso, o óleo de banana pode causar irritação de pele, olhos, nariz e garganta, dor de cabeça e náuseas.  “O Batismo de Cristo” Piero della Francesca (~ 1450) Têmpera de ovo sobre álamo National Gallery, Londres, RU O estudo da composição química dos odores de frutas é feito por cromatografia de fase gasosa. Através dessa técnica pode-se identificar os ésteres presentes em frutas como o maracujá e o cajá. Devido a seus odores agradáveis, muitos ésteres são empregados na confecção de perfumes. Perfumes são, na verdade, uma mistura complexa de ésteres, aldeídos e hidrocarbonetos. Essa palavra tem origem no latim: per (através) e fumare (fumaça), o que relembra suas origens religiosas, quando madeiras e outros materiais odoríferos eram queimados em oferenda aos deuses.  Santiago de Compostela e Hinduísmo Além dos ésteres de cadeia aberta, diversas lactonas (ésteres cíclicos) também estão presentes em frutas e flores, sendo fundamentais para seus aromas específicos. Veja:
Aldeídos e cetonas na naturezaAlém dos ésteres, aldeídos e cetonas voláteis também possuem propriedades odoríferas, fazendo parte dos aromas de frutas, flores e outros materiais de origem natural. Os aldeídos constituem uma das principais famílias olfativas empregadas na confecção de perfumes. O citral, um dos componentes mais comuns de perfumes com toques cítricos, é na verdade uma mistura de dois aldeídos isoméricos: o geranial e o neral. Esses aldeídos diferem entre si pela estereoquímica da ligação dupla conjugada com o grupamento aldeído: enquanto no neral ela possui a estereoquímica Z, no geranial essa mesma ligação dupla possui estereoquímica E. Essa pequena diferença estrutural confere às duas moléculas propriedades olfativas diferentes, já que o geranial possui um forte odor cítrico, que remete ao limão, e o neral tem um odor menos acentuado, porém mais adocicado. Além de seu uso na indústria de perfumaria, essa mistura de aldeídos também é empregada na indústria alimentícia para reforçar o sabor de limão de balas e outros comestíveis.  A importância dos aldeídos na confecção de perfumes é tão grande que uma das famílias olfativas é denominada aldeídica, participando das chamadas notas de cabeça e de corpo de perfumes, devido à volatilidade desses compostos. O famoso Chanel no 5, criado em 1925 por Ernest Beaux, foi o primeiro perfume famoso a empregar aldeídos sintéticos em sua composição, fugindo ao padrão até então empregado, que fazia com que os perfumes fossem totalmente naturais. Entre os aldeídos empregados em perfumaria estão o aldeído undecilênico (10-undecenal) e o aldeído láurico (dodecanal).  Chanel nº 5 Cetonas também são muito utilizadas na indústria de perfumes. Uma delas, a muscona, cujo nome oficial é (R)-3-metilciclopentadecanona, é o principal componente do odor de almíscar, que na natureza é encontrado em glândulas presentes nas quatro espécies de veado almiscareiro (Moschus ssp.). Por ser necessário sacrificar o animal para a remoção dessa glândula, tais espécies se encontram ameaçadas de extinção, o que tem promovido o uso de substâncias sintéticas com propriedades olfativas semelhantes à muscona, como o 2-t-butil-4-metil-1,3,5-trinitrobenzeno.   Veado almiscareiro Outras cetonas naturais empregadas em perfumaria são a civetona, obtida da civeta africana, a jasmona, extraída do jasmim, e a α-irona, componente do aroma de violetas.
Aldeídos e cetonas - estruturaAldeídos e cetonas possuem, em comum, a presença de um grupamento carbonila. Nesse grupo funcional existe um átomo de carbono de hibridização sp2 ligado a um átomo de oxigênio (também com hibridização sp2) por uma ligação dupla e a outros dois substituintes; como o átomo de carbono sp2 é trigonal, esses substituintes se encontram no mesmo plano que o átomo de oxigênio e seus dois pares de elétrons livres:  Olhe com mais detalhes esse grupo funcional. Como existe uma ligação dupla entre os átomos de carbono e de oxigênio, existem dois tipos de ligação nesse grupo: uma σ e outra π. A ligação s corresponde a um orbital ligante σ, que vem da combinação de dois orbitais atômicos hibridizados sp2 (um do carbono e outro do oxigênio), enquanto a ligação π, correspondente a um orbital ligante π, vem da combinação de dois orbitais atômicos não hibridizados π. Entretanto, como o número de orbitais moleculares formados tem que ser igual ao número de orbitais atômicos combinados, e como foram combinados quatro orbitais atômicos (um sp2 e um π de cada átomo), são formados quatro orbitais moleculares: dois ligantes (σ e π) e dois antiligantes (σ* e π*), que permanecem vazios (sem elétrons) no estado eletrônico fundamental da molécula que contém a carbonila. Veja o diagrama de energia desses orbitais:  Os orbitais π e π* podem ser graficamente representados da seguinte forma:  Orbital π e orbital π* O valor médio de comprimento da ligação C=O é de 1,22 Å (122 pm), e o valor médio da energia dessa ligação é de 732 kJ/mol (175 kcal/mol), embora esse valor varie de acordo com os ligantes do átomo de carbono: para o formaldeído, a energia dessa ligação é de 166 kcal/mol, enquanto para os demais aldeídos o valor médio é de 176 kcal/mol e, para as cetonas, de 179 kcal/mol. Outra propriedade importante das carbonilas é o momento de dipolo gerado pela diferença de eletronegatividade entre os átomos de carbono e oxigênio. O valor desse momento de dipolo também varia em função do tipo de composto: para o formaldeído, ele é de 2,33 D, enquanto para o acetaldeído é de 2,72 D e para a acetona é de 2,82 D. Essa variação de dipolo pode ser explicada pelo efeito indutivo dos ligantes do átomo de carbono: no caso do formaldeído, temos dois átomos de hidrogênio ligados ao carbono, que, por definição, não possuem efeito indutivo. No acetaldeído, um dos ligantes é um grupamento alquila, que possui efeito indutivo I+, ou seja, doador de elétrons, o que aumenta a densidade eletrônica do átomo de carbono e, conseqüentemente, do átomo de oxigênio, já que o compartilhamento dos pares eletrônicos da ligação C=O será menor, estando esses elétrons mais disponibilizados para o átomo mais eletronegativo, ou seja, o átomo de oxigênio. Isso é ainda mais acentuado na acetona, porque são dois grupos alquila exercendo efeito I+.  Mapa de potencial eletrostático de formaldeído, acetaldeído e acetona No grupamento carbonila, esse dipolo pode ser visualizado pelo desenho de suas formas de ressonância:  É possível explicar a diferença de momento de dipolo das carbonilas de formaldeído, acetaldeído e acetona também através destas formas de ressonância: na acetona, ocorre uma maior estabilização da forma de ressonância em que há separação de cargas, já que existem dois grupos com efeito I+ ligados ao átomo de carbono deficiente em elétrons, enquanto no outro extremo está o formaldeído, em que os dois átomos de hidrogênio ligados ao carbono não fornecem qualquer estabilização a essa forma de ressonância. Como a contribuição da forma de ressonância (hipotética) para as propriedades do híbrido de ressonância (composto real) aumenta conforme aumenta sua estabilidade, a contribuição da forma com separação de cargas (e maior momento de dipolo) é maior para a acetona do que para o formaldeído.
Aldeídos e cetonas - nomenclaturaA nomenclatura oficial de aldeídos e cetonas é dada a partir do nome do hidrocarboneto correspondente, acrescentando-se o sufixo al para os aldeídos e o sufixo ona para as cetonas; neste último caso, quando houver possibilidade de ambigüidade, deve-se indicar a posição em que esse grupamento se localiza na cadeia hidrocarbônica. Certos aldeídos e cetonas possuem nomenclatura própria:  No caso de haver um grupamento funcional de prioridade maior que a cetona para fins de nomenclatura (ácidos carboxílicos e derivados, aldeídos), a função cetona será representada pelo termo oxo.  Se o grupamento aldeído estiver ligado a um anel hidrocarbônico, a nomenclatura é feita pela adição do termo carboxaldeído ao nome do hidrocarboneto.  Se houver outro grupo de maior prioridade que o aldeído na molécula, este será representado pelo termo formil. A nomenclatura vulgar de aldeídos segue a nomenclatura vulgar dos ácidos carboxílicos de mesma cadeia:  A acroleína é um derivado tóxico da decomposição do glicerol e de óleos comestíveis por processos químicos ou bacteriológicos. É produzida na queima de tabaco, de óleos de cozinha e de carros e é empregada como algicida, bactericida, moluscicida e no controle de crescimento de plantas, além de poder ser utilizada em guerra química. Seu uso no controle de pragas leva à contaminação de águas e solos, causando danos ambientais severos. Sua inalação promove irritação do trato respiratório, náuseas, vômito, úlceras gástricas e pode até levar à morte.  Por sua vez, a nomenclatura vulgar de cetonas é feita pela adição dos nomes dos radicais alquila (por ordem de tamanho de cadeia) ligados à carbonila ao termo cetona: 
A acetona é um solvente muito conhecido; era muito empregado na remoção de esmaltes de unha, até que sua comercialização foi proibida pela Polícia Federal, visando restringir o uso desse solvente no refino de cocaína. A acetona é importante também em termos médicos, porque trata-se de um dos corpos cetônicos, e sua produção acentuada no organismo (cetose) indica a presença de distúrbios como diabetes, subnutrição ou dieta desequilibrada; além disso, o portador de cetose exala um cheiro desagradável pela pele. 
Ésteres - estruturaOs ésteres, assim como os aldeídos e as cetonas, caracterizam-se pela presença de um grupamento carbonila. Entretanto, um dos ligantes da carbonila é outro átomo de oxigênio (que denominamos oxigênio éter), que pode compartilhar seus pares de elétrons livres com a carbonila, como você pode observar nas formas de ressonância a seguir:  Desta forma, é possível predizer que o átomo de oxigênio de maior caráter básico nos grupamentos éster é o oxigênio carbonílico, já que esta é uma forma de ressonância em que ele assume uma carga negativa, ou seja, maior densidade eletrônica que o oxigênio éter. Como bases são átomos ou grupos capazes de doar pares de elétrons, segundo Lewis, o átomo com maior densidade eletrônica será o mais básico: 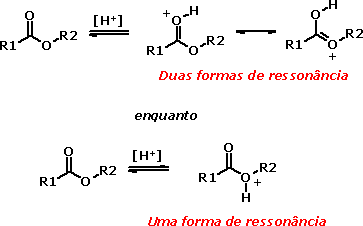 Essa mesma característica pode ser observada também em outras funções em que a carbonila esteja ligada a átomos contendo pares de elétrons livres, como nas amidas.
Ésteres - nomenclaturaOs ésteres possuem nomenclatura derivada dos ácidos carboxílicos correspondentes, substituindo o sufixo ico pelo sufixo ato e acrescentando a palavra de e o nome do radical hidrocarbônico ligado ao oxigênio da carboxila.  Os nomes vulgares dos ésteres são formados da mesma forma, empregando porém a nomenclatura vulgar do ácido carboxílico de origem.  As lactonas também têm sua nomenclatura derivada do ácido carboxílico correspondente, substituindo o sufixo óico por olactona. Também se adiciona uma letra grega para referenciar o tamanho do anel (b para anéis de 4 membros, g para anéis de cinco membros, d para anéis de seis membros).  Lactonas de ácidos alifáticos podem ser nomeadas pela adição do sufixo olídeo ao nome do hidrocarboneto correspondente, indicando a posição da hidroxila que origina o anel lactônico. Também se pode dar nome a lactonas a partir do éter heterocíclico correspondente, adicionando o sufixo ona para representar a carbonila lactônica:  Existem muitas lactonas de origem natural que possuem nomes próprios, como a cumarina. Estudos demonstraram que essa substância é o princípio ativo do guaco, planta que é utilizada popularmente para o tratamento de asma e outros distúrbios respiratórios.  Folha de guaco Derivados hidroxilados da cumarina, como o dicumarol e a warfarina, são potentes agentes anticoagulantes. O dicumarol é formado, por exemplo, por uma reação de oxidação da cumarina por fungos; assim, quando plantas contendo cumarina utilizadas como forragem para o gado sofrem contaminação fúngica, forma-se dicumarol, que provoca hemorragias nestes animais. Isso pode ocorrer, por exemplo, com o meliloto ou trevo de cheiro amarelo, planta européia aclimatada no cerrado brasileiro e utilizada popularmente para o tratamento de distúrbios circulatórios, e a glicirídia, usada em cercas vivas. O dicumarol também é utilizado no combate a morcegos hematófagos transmissores do vírus da raiva: capturam-se alguns desses morcegos e pincelam-se seus corpos com uma solução de dicumarol; ao retornar às cavernas onde habitam, os outros morcegos os lambem, ingerindo o dicumarol e morrendo de hemorragia interna. Derivados de cumarina também são empregados como veneno para ratos.   Morcego vampiro Propriedades físico-químicas de aldeídos, cetonas e ésterObserve o gráfico a seguir. Ele relaciona o ponto de ebulição de aldeídos, cetonas e ésteres com seus pesos moleculares: 
As interações intermoleculares entre esses compostos são de dois tipos: dipolo-dipolo, envolvendo as carbonilas, e interações de van der Waals, envolvendo as cadeias hidrocarbônicas. Com isso em mente, veja uma análise do gráfico:
Aldeídos e cetonas existem em equilíbrio com suas formas tautoméricas, os enóis:  Geralmente esse equilíbrio encontra-se quase totalmente deslocado na direção dos compostos carbonilados, embora a formação do enol possa ser favorecida se ocorrer aumento da estabilidade do composto, como aumento da conjugação de sistemas π ou formação de ligações hidrogênio intramoleculares.  Enóis possuem caráter ácido, devido à estabilização por ressonância da sua base conjugada (enolato). 
Este site foi atualizado em 16/01/11 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||