![]() Entropia
ou Função “S” de Clausius
Entropia
ou Função “S” de Clausius![]()
A entropia ou função “S” foi introduzida em 1865 por Clausius e é uma grandeza termodinâmica que mede a organização de um sistema. Um sistema organizado apresenta baixa entropia enquanto um sistema desorganizado apresenta elevada entropia.
Observe os seguintes fatos:
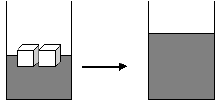
a) derreter gelo num copo d’água.
b) abrir uma torneira que liga dois recipientes sendo um com gás e outro tendo vácuo.
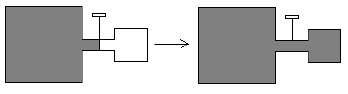
Observa-se na prática que os fenômenos inversos não ocorrem espontaneamente. Mas, por quê?
A resposta é dada pelo 2º Princípio da Termodinâmica que diz:

Em Física temos:

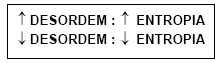
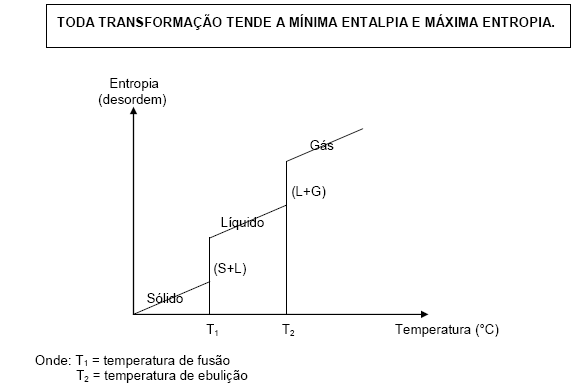
A tendência espontânea dos sistemas é de adquirir MAIOR ENTROPIA:
IMPORTANTE
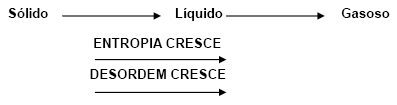
1) Uma substância no estado cristalino tem entropia mais baixa, pois, no cristal, as moléculas ou íons estão ordenados geometricamente nos nós do retículo.
2) Uma substância no estado líquido tem entropia maior que no estado sólido, porque, no estado líquido as partículas estão distribuídas ao acaso (desordem).
3) Uma substância no estado gasoso tem entropia maior que no estado líquido.
Logo, ficamos com:
4) A dissolução de um sólido em um determinado líquido se faz com aumento de entropia, pois as moléculas ou íons do sólido ficam caoticamente distribuídos no solvente passando a um estado mais desorganizado.
5) A mistura de dois gases também desorganiza o sistema e aumenta sua entropia. Imaginemos a saída de um estádio de futebol. Praticamente seria impossível obter espontaneamente uma saída organizada, a tendência é ocorrer a mais desorganizada possível, ou seja, a de máxima entropia.
Portanto podemos concluir que:
![]() ENERGIA
LIVRE OU DE GIBBS
ENERGIA
LIVRE OU DE GIBBS![]()
A variação de energia de uma transformação que é utilizável ou disponível para realizar um trabalho, damos o nome de variação de energia livre (∆G).
Imagine, por exemplo, uma reação que libera calor (energia). Se uma parte dessa energia for gasta no trabalho de pôr em ordem as moléculas finais da reação, sobrará apenas a diferença da energia para realizar algum trabalho que nos seja útil.
Como é calculado o trabalho para colocar as moléculas em ordem?
Todos nós sabemos que colocar as coisas em ordem – arrumar os móveis de uma sala, os livros numa prateleira, etc. – dá trabalho, ou seja, gasta energia. Desta forma, alguns cientistas calcularam que para arrumar as moléculas se gasta uma energia de organização, que é igual ao produto da temperatura absoluta pela variação de entropia sofrida pelo sistema: T . ∆S.
Resumindo temos:
Energia liberada pela reação: ∆H
Energia gasta na organização: T . ∆S
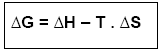
Saldo de energia aproveitável: ∆H – T . ∆S
Esse saldo é denominado ENERGIA LIVRE (ou Energia de Gibbs ou Energia Útil), e é representado por ∆G:
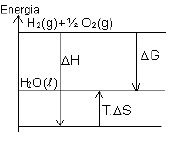
Exemplo:
H2(g) + ½ O2(g)
![]() H2O(
H2O(![]() )
)
Em que: ∆H = - 68,3 kcal/mol e ∆S = - 39 kcal/mol
O que nos permite calcular:
- A energia liberada na reação: ∆H = - 68,3 kcal/mol = - 68.300 cal/mol
- A energia gasta para montar as moléculas de H2O e agrupá-las no estado líquido:
T . ∆S = 298 . (- 39) = - 11.622 kcal/mol
- Saldo de energia (energia útil para realizar trabalho):
∆G = ∆H – T . ∆S
∆G = - 68.300 + 11.622
∆G = - 56.678 kcal/mol
Graficamente, temos:
ESPONTANEIDADE DE UM PROCESSO
Dois fatores vão dizer se um processo é espontâneo ou não:
a) Os sistemas tendem para um estado de mais baixa energia.
Tendência: ∆H = – ou HP < HR
b) Os sistemas tendem para um estado de maior desorganização.
Tendência: T . ∆S = +
Variação de energia livre (∆G ou ∆F) é o balanço entre essas duas variações.
∆G = ∆H – T . ∆S
Transformação espontânea (∆G < 0)
A energia livre diminui.
A transformação é capaz de libertar energia útil (reação exergônica).

Transformação não espontânea (∆G > 0)
A energia livre aumenta.
A transformação não é capaz de libertar energia útil (reação endergônica). A transformação só é possível pelo fornecimento de trabalho ao sistema.

Equilíbrio químico (∆G = 0)
Como ∆G = 0, logo ficamos com: ∆H = T . ∆S
Isto significa que o processo não evolui.
De um modo geral, analisando a fórmula:
∆G = ∆H – T . ∆S
Podemos concluir que qualquer sistema tende para um mínimo de entalpia (∆H mais negativo possível) e para um máximo de entropia (∆S mais positivo possível).
Com isso ficamos com:
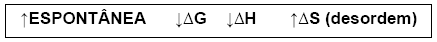
IMPORTANTE
- Tanto as reações exotérmicas como as endotérmicas poderão ser espontâneas dependendo do sinal de ∆G e não do ∆H.
- |∆H|é grande e pouco afetado pela temperatura.
- |∆S|é pequeno e pouco afetado pela temperatura.
Sendo assim:
- Em temperaturas (T) baixas, T . ∆S influi pouco; ∆H torna-se dominante e ∆G tem o mesmo sinal de ∆H; nesse caso, uma reação exotérmica (∆H < 0) tem muita possibilidade de ser espontânea (∆G < 0).
- Em temperaturas (T) altas, T . ∆S aumenta, podendo inclusive acontecer |T . ∆S| > |∆H|; por este motivo, muitas reações “tornam-se espontâneas em temperaturas altas.
Exemplo:
C(grafite) + 2 S(rômbico)
![]() CS2(g)
CS2(g)
Nessa reação temos:
∆H = + 27.500 cal/mol
∆S = + 40,2 cal/K . mol
Em temperatura ambiente: 25ºC (298 K)
Sabendo que: ∆G = ∆H – T . ∆S
Substituindo os dados na fórmula teremos:
∆G = 27.500 – 298 . 40,2 ![]() ∆G
= + 15.520 cal/mol
∆G
= + 15.520 cal/mol
O valor ∆G > 0 mostra definitivamente que a reação não é espontânea.
Entretanto, em temperaturas superiores a 412ºC (685 K) temos:
T . ∆S = 685 . 40,2 = + 27.537 cal/mol
Este valor supera o ∆H = + 27.500 cal/mol, tornando o ∆G < 0 e, conseqüentemente, tornando a reação espontânea.
Resumindo temos:
- quando ∆H for negativo e ∆S positivo, a reação será sempre espontânea.
- quando ∆H for negativo e ∆S negativo, a reação só será espontânea em temperaturas baixas.
- quando ∆H for positivo e ∆S positivo, a reação só será espontânea em temperaturas altas.
- quando ∆H for positivo e ∆S negativo, a reação nunca será espontânea.
Este site foi atualizado em 04/03/19