 ADIÇÃO
EM ALCADIENOS
ADIÇÃO
EM ALCADIENOS
Alcadienos são hidrocarbonetos
alifáticos insaturados por duas duplas-ligações, de fórmula geral CnH2n
– 2 . São também denominados de dienos ou diolefinas.
1.
Classificação
Os alcadienos são classificados
conforme a posição das duplas-ligações.
I.
Alcadienos acumulados
Quando as duas duplas estão no
mesmo carbono.
Exemplos

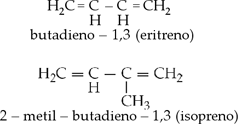
II. Alcadienos conjugados
Quando as duas duplas estão
separadas por uma ligação simples.
Exemplos
III. Alcadienos isolados
Quando as duas duplas estão
separadas por mais de uma ligação simples.
Exemplos
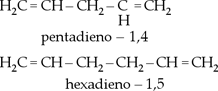
Os mais importantes dos
alcadienos são conjugados porque possuem maior estabilidade e grande
importância industrial.
2. Propriedades Químicas
dos Alcadienos
A
exemplo dos alcenos, aqui também ocorre reação de adição eletrofílica.
Evidentemente tendo duas duplas-ligações, os dienos darão essas reações em
dobro (parcial e total) quando comparadas com os alcenos.
A
reação mais interessante, contudo, ocorre com os dienos conjugados, por
exemplo.

A
adição 1,2 não tem nada de extraordinário. A grande novidade é o
aparecimento da adição 1,4 onde os bromos se ligam nas extremidades e a
dupla pula para a posição central. A adição 1,4 é típica dos
alcadienos conjugados. Porém, é claro que a adição de mais bromo à reação
será de adição total.
Exemplo
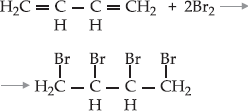
Mecanismo da Adição 1,4
É um mecanismo iônico do tipo
adição eletrófila. Deste modo, a reação entre o
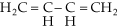 e o bromo
será assim explicada.
e o bromo
será assim explicada.
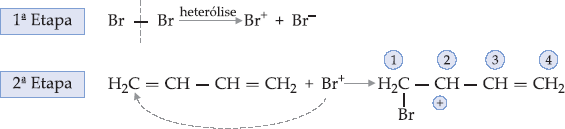
Aqui surge a novidade: os carbonos (3) e (4) têm um excesso de
elétrons que é representado pela ligação dupla (orbital
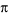 ). Eles
podem, então, ceder esse excesso de elétrons em socorro ao carbono
(2) que ficou positivo (íon de carbônio) e este processo de transferir o
elétron denomina-se ressonância.
). Eles
podem, então, ceder esse excesso de elétrons em socorro ao carbono
(2) que ficou positivo (íon de carbônio) e este processo de transferir o
elétron denomina-se ressonância.
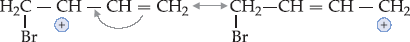
Com isso, a dupla-ligação pula para o centro da molécula e o carbono
(4) fica positivo. Você poderia perguntar: qual a vantagem disso?
A
vantagem é que agora o ônus da carga positiva (que nenhum carbono
tolera) está sendo dividido entre os carbonos (2) e (4) e, deste modo, o
conjunto (híbrido de ressonância) fica mais estável.
Home | Substituição Alcanos | Substituição Aromáticos | Adição Alcenos | Adição Alcinos | Adição Alcadienos | Adição Substituição Ciclanos | Eliminação | Oxidação | Esterificação | Saponificação
Este site foi atualizado em
04/03/19