PROPRIEDADES
COLIGATIVAS
PROPRIEDADES
COLIGATIVAS


Aditivo do radiador: evita o congelamento e a ebulição da água que refrigera o motor do carro.
ÍNDICE
| Efeitos Coligativos | |
| Pressão Máxima de Vapor | |
| Tonoscopia | |
| Ebulioscopia | |
| Crioscopia | |
| Lei de Raoult | |
| Osmose | |
| Pressão Osmótica (Osmoscopia) | |
| Classificação de uma solução quanto a natureza do soluto | |
| Saiba Mais |
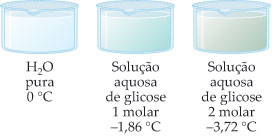
A água pura à pressão de 1 atm possui ponto de fusão de 0oC e ponto de ebulição de 100oC.

Água Pura
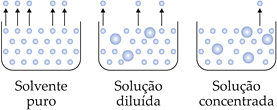
No entanto, quando adicionamos um soluto não volátil à água, o soluto modifica as propriedades físicas da água. Agora a água congela abaixo de 0oC e ferve acima de 100oC. Estas alterações das propriedades físicas da água devido à adição do soluto são denominados de efeitos coligativos.

Adição de um soluto não volátil à água
Para cada propriedade física que modifica temos uma propriedade coligativa que estuda este efeito:
| EFEITO COLIGATIVO | PROPRIEDADE COLIGATIVA |
| Diminuição da pressão de vapor | Tonoscopia |
| Aumento do Ponto de Ebulição | Ebulioscopia |
| Diminuição do Ponto de Congelamento | Crioscopia |
| Aumento da Pressão Osmótica | Osmoscopia |
Os efeitos coligativos dependem somente do número de partículas do soluto dissolvidas. Quanto maior for o número de partículas do soluto dissolvidas, maiores serão os efeitos coligativos.
1. Definição
Vamos imaginar um cilindro munido de um êmbolo totalmente apoiado em um líquido puro contido no seu interior.
Se elevarmos o êmbolo, criaremos um espaço vazio, e o líquido começará a vaporizar-se.
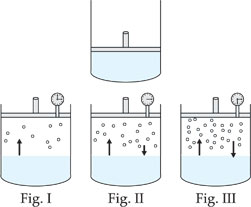
I) Inicialmente temos evaporação, pois ainda não existem moléculas no estado de vapor;
II) A velocidade de evaporação é maior que a velocidade de condensação;
III) Após algum tempo, a velocidade de condensação iguala-se à velocidade de evaporação e o sistema atinge um equilíbrio dinâmico: a cada unidade de tempo, o número de moléculas que passam para o estado gasoso é igual ao nº de moléculas que retornam para a fase líquida;
Em resumo, no início, a velocidade com que o líquido passa a vapor é alta e a velocidade com que o vapor volta ao líquido é baixa. No decorrer do processo, a velocidade com que o líquido passa a vapor vai diminuindo, e aumenta a velocidade com que o vapor volta ao líquido. Quando temos a impressão de que o processo parou, o que ocorreu realmente foi um equilíbrio, isto é, as duas velocidades se igualaram.
Nesta situação, dizemos que foi atingida a pressão máxima de vapor do líquido.
2. Fatores que Influenciam
A pressão máxima de vapor depende de alguns fatores:
2.1. Natureza do Líquido
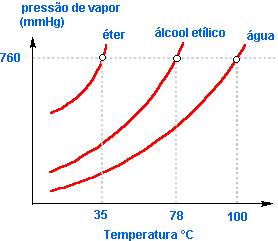
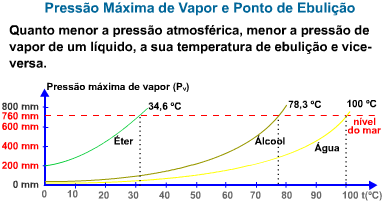
Líquidos mais voláteis como éter, acetona etc. evaporam-se mais intensamente, o que acarreta uma pressão de vapor maior.
O gráfico abaixo mostra a variação da pressão de vapor de alguns líquidos em função da temperatura.
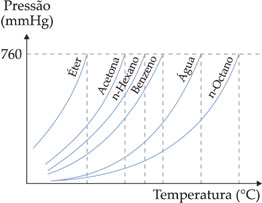
O gráfico mostra que quanto maior a pressão de vapor de um líquido, ou melhor, quanto mais volátil ele for, mais rapidamente entrará em ebulição.
2.2. Temperatura
Aumentando a temperatura, qualquer líquido irá evaporar mais intensamente, acarretando maior pressão de vapor.
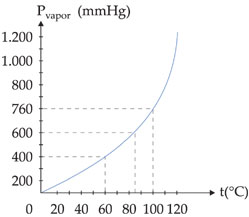
Observe a variação de pressão máxima de vapor da água em função da temperatura e o respectivo gráfico:
Observação – A passagem de uma substância da fase líquida para a fase gasosa pode ocorrer de duas formas:
I. Evaporação
Consiste em uma vaporização relativamente lenta, em que as moléculas mais velozes vencem as forças de atração intermoleculares e passam para o estado gasoso.
A evaporação depende da superfície de contato entre o líquido e fase gasosa: quanto maior for a superfície de contato, mais intensa será a evaporação.
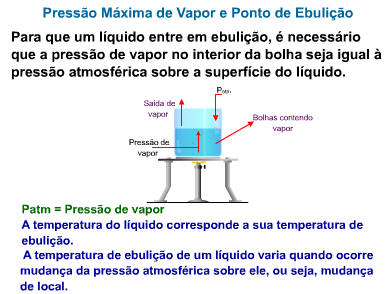
II. Ebulição
É uma vaporização turbulenta, na qual a passagem da fase líquida para a gasosa pode ocorrer em qualquer ponto da fase líquida, e não apenas na superfície. Esse tipo de vaporização apresenta como característica a formação de bolhas, isto é, porções de vapor cercadas por uma película de líquido.
As bolhas só podem existir se a pressão de seu vapor for igual ou maior que a pressão externa – a pressão atmosférica mais a pressão da massa líquida, que comumente é desprezível.
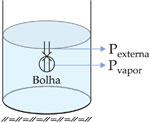
Um líquido entra em ebulição quando a sua pressão de vapor se iguala à pressão atmosférica.
|
Pvapor = Patm |
Exemplo – O gráfico abaixo mostra a variação da pressão de vapor da água em função da temperatura.
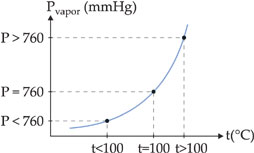
Ao nível do mar, onde a pressão atmosférica é de 760 mmHg, a água ferve a 100 °C. Isto quer dizer que a 100 °C a pressão da água é igual a 760 mmHg. Observando-se o gráfico acima, verifica-se que a temperaturas diferentes o líquido também pode ferver, bastando, para isso, que se altere a pressão externa que atua sobre ele.
Assim, no alto de uma montanha, onde a pressão atmosférica é menor que 1 atm, a água ferve abaixo de 100 °C, enquanto em uma panela de pressão, onde a pressão é superior a 1 atm, a água ferve acima de 1000C.
A temperatura na qual o líquido ferve, sob pressão de 1 atm, é chamada de temperatura de ebulição normal ou ponto de ebulição normal.
Desta forma, o ponto de ebulição normal da água é de 100°C.
Exemplo – No pico Everest, a água ferve em torno de 70 °C; numa panela de pressão, ela ferve em torno de 110°C.
3. Diagrama de Fases da Água
Se representarmos em um mesmo gráfico a variação da temperatura de ebulição e a variação de temperatura de solidificação da água em função de sua pressão de vapor, obteremos o seguinte.
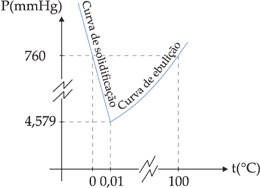
No ponto onde a pressão é igual a 4,579 mmHg, a temperatura é igual a 0,01 °C e a curva de ebulição coincide com a curva de solidificação da água. Isso significa que nessa pressão e temperatura temos o equilíbrio:
água sólida
![]() água líquida
água líquida
![]() água vapor
água vapor
Esse ponto (4,579 X 0,01) é chamado de ponto triplo da água. Abaixo de 4,579 mmHg, a água passa diretamente da fase sólida à fase de vapor, ou seja, ocorre a sublimação.
Se acrescentarmos ao gráfico acima a variação da temperatura em pressão abaixo de 4,579 mmHg, obteremos a curva de sublimação.
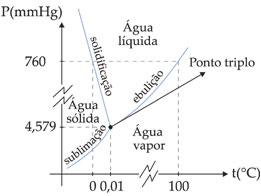
O gráfico anterior é conhecido como diagrama de fase da água. Nele, observamos que:
• No ponto triplo coexistem as 3 fases de equilíbrio:
água sólida
![]() água líquida
água líquida
![]() água vapor
água vapor
• Na curva de sublimação coexistem as fases sólida e vapor:
água sólida
![]() água vapor
água vapor
• Na curva de solidificação coexistem as fases sólida e líquida:
água sólida
![]() água líquida
água líquida
• Na curva de ebulição coexistem as fases líquida e vapor:
água líquida
![]() água vapor
água vapor
• Em toda região à direita das curvas de ebulição e de sublimação existe somente a fase vapor d’água.
• Em toda região entre as curvas de solidificação e de ebulição existe somente a fase líquida da água.
É o estudo do abaixamento da pressão máxima de vapor de um líquido, que é ocasionado pela dissolução de um soluto não-volátil.
A pressão de vapor da solução formada por um soluto (não-volátil) em solvente é menor que a do solvente puro, pois a interação entre as partículas do soluto e as moléculas do solvente diminuem as saídas destas últimas. Portanto, quanto maior o número de partículas do soluto em solução, maior o abaixamento da pressão máxima de vapor e menor a pressão de vapor do solvente.
Esquematicamente, podemos representar:
Efeito Tonoscópico
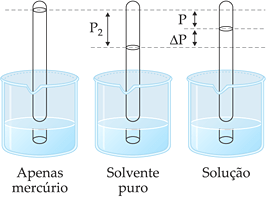
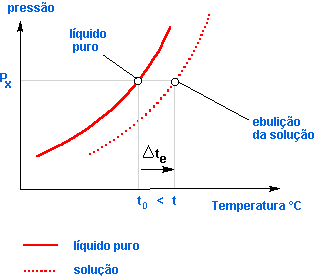
A experiência mostra que a dissolução de uma substância não-volátil num solvente provoca o abaixamento de sua pressão de vapor, isto é, a cada temperatura, a solução possui menor pressão de vapor que o solvente puro.
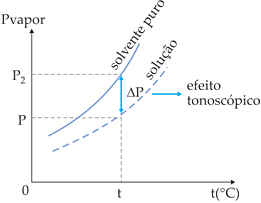
O diagrama mostra o abaixamento da pressão de vapor da solução em relação ao solvente puro, sendo:
p2: pressão de vapor do solvente puro;
p = pressão de vapor da solução;
Δp = p2 – p = abaixamento absoluto da pressão de vapor;
![]() = abaixamento relativo da pressão de vapor.
= abaixamento relativo da pressão de vapor.
É o estudo da elevação da temperatura de ebulição de um líquido, por meio da adição de um soluto não volátil.
A diminuição da pressão máxima de vapor do solvente, devido à adição de um soluto, leva inevitavelmente ao aumento da temperatura de ebulição.
Quanto maior a concentração do soluto, maior a elevação da temperatura de ebulição do solvente e maior a temperatura de ebulição do mesmo.
Dte = Elevação da temperatura de ebulição
![]()
Onde temos:
te2 = temperatura de ebulição do solvente puro;
te = temperatura de ebulição do solvente na solução.
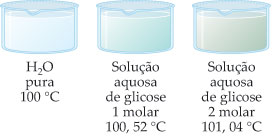
Exemplos:
– Solução Glicose 1 M:
Dte = 100,52 – 100
Dte = 0,52 °C
– Solução Glicose 2 M:
Dte = 101,04 – 100
Dte = 1,04 °C

Efeito Crioscopico do sal no Ponto de Solidificação da água: à direita água pura com Ponto de Solidificação de 0oC e a esquerda água e sal com Ponto de Solidificação de -18oC.
É o estudo do abaixamento da temperatura de congelação de um líquido, por meio da adição de um soluto.
A diminuição da pressão de vapor do solvente, devido à adição de um soluto, leva à diminuição da temperatura de congelamento.
Quanto maior a concentração do soluto, maior o abaixamento da temperatura de congelamento do solvente e menor a temperatura de congelamento do mesmo.
Dtc = Abaixamento da temperatura de congelamento
![]()
Onde temos:
tc2 = temperatura de congelamento do solvente puro;
tc = temperatura de congelamento do solvente na solução.
Exemplos:
– Solução Glicose 1 M:
Dtc = 0 – (– 1,86)
Dtc = 1,86 °C
– Solução Glicose 2 M:
Dtc = 0 – (–3,72)
Dtc = 3,72 °C
Graficamente, podemos representar os efeitos ebulioscópico e crioscópico.
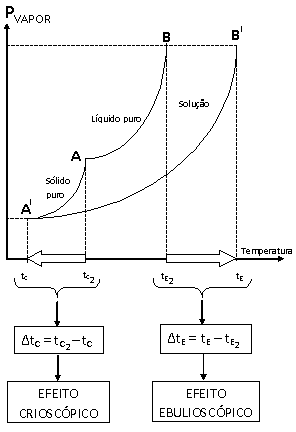
Onde:
• tc = temperatura de solidificação do líquido na solução;
•
![]() = temperatura de solidificação do líquido puro;
= temperatura de solidificação do líquido puro;
• ΔtC= efeito crioscópico;
• te = temperatura de ebulição do líquido na solução;
•
![]() = temperatura de ebulição do líquido puro;
= temperatura de ebulição do líquido puro;
• ΔtE= efeito ebulioscópico;
• No ponto A ocorre a solidificação do líquido puro;
• No ponto A' ocorre a solidificação do líquido na solução;
• No ponto B ocorre a ebulição do líquido puro;
• No ponto B' ocorre a ebulição do líquido na solução.
Em 1878 o químico francês François-Marie Raoult (1830-1901) afirma que o efeito coligativo de um soluto não volátil molecular em um solvente é diretamente proporcional à molalidade da solução:
Efeito Coligativo = K . W
onde:
K = constante de proporcionalidade
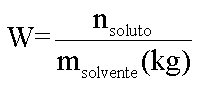
Portanto para os efeitos coligativos teremos:
Tonoscopia
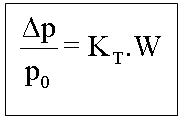
Onde: KT=Constante tonoscópica molal (Msolvente/1000)
Ebulioscopia
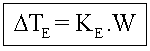
Onde: Ke=Constante ebulioscópia molal (Msolvelte/1000)
Crioscopia
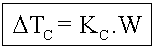
Onde: Kc=Constante crioscópica molal (Msolvente/1000)
Você sabia que...
Quem congela primeiro: água quente ou água fria?
![[cubos_gelo.jpg]](http://4.bp.blogspot.com/_Y2RnXgpHOWk/SJcdxt2w4RI/AAAAAAAAAEg/5afuI-y5mJA/s1600/cubos_gelo.jpg)
Trata-se do seguinte: colocando-se no congelador dois copos iguais cheios de água, um a temperatura ambiente (30°C) e outro saído da chaleira (70°C), qual congelará primeiro? Surpreendemente, a água que inicia mais quente congela primeiro
Bom, na verdade a água quente não congela mais rapidamente que a água fria, é claro. Mas se você ferve água e depois deixa que ela resfrie até a temperatura ambiente, ela congelará mais rapidamente que uma outra quantidade de água que não tenha sido aquecida antes. Estranho?
Não, e vamos ver o porquê. Quando você aquece a água, ela perde parte do ar dissolvido nela, que sai em forma de bolhas, e o ar é um mau condutor térmico. Assim, o ar presente na água dificulta as trocas de calor com o meio e dificulta a perda de calor que a água precisa sofrer para que aconteça o congelamento
Por essa mesma razão, o gelo formado por água previamente fervida tem densidade maior do que aquele que se obtém com água que não passou por esse processo. Em países muito frios, o que não é o caso do Brasil, os canos de água quente tendem a arrebentar antes do que os de água fria, pois congelam primeiro
Osmose é a passagem de um solvente para o interior de uma solução feita desse mesmo solvente, através de uma membrana semipermeável (MSP). A osmose também é uma propriedade coligativa da solução, pois depende do número de partículas dissolvidas.
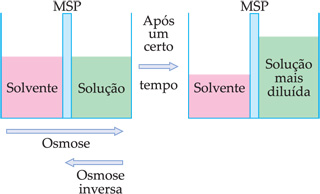
Nota:
A membrana semipermeável (MSP), que pode ser feita de bexiga de animal ou celofane, é seletiva, ou seja, deixa passar o solvente, mas não deixa passar o soluto.
Observa-se que o nível do solvente diminui após um certo tempo, enquanto o nível da solução aumenta.
Exemplo:
Dadas duas soluções, A e B, inicialmente 0,1 M e 0,2 M, separadas por uma membrana semipermeável.
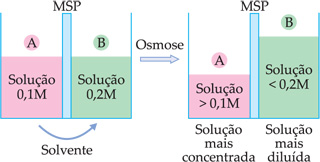
Verifica-se que as soluções A e B mudam de concentração após a osmose.
Pressão osmótica é a pressão que se deveria aplicar sobre a solução para impedir a passagem do solvente através da membrana semipermeável. A pressão osmótica é representada pela letra grega p. Essa pressão é equivalente à pressão exercida pelo solvente na passagem através da membrana.
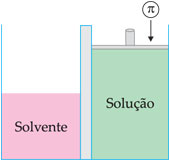
Osmoscopia é a medida da pressão osmótica, que pode ser medida por aparelhos chamados osmômetros.
Soluções isotônicas são soluções de mesma pressão osmótica. Uma solução será hipotônica em relação à outra, quando tiver menor pressão osmótica; e será hipertônica quando tiver maior pressão osmótica.
Exemplo:
Uma solução 0,4 molar de um certo soluto será hipertônica em relação a uma solução 0,1 molar do mesmo soluto, no mesmo solvente e à mesma temperatura.
Leis de Van’t Hoff para a Osmose
1a) A pressão osmótica é diretamente proporcional à temperatura absoluta da solução:
![]()
2a) A pressão osmótica é diretamente proporcional à concentração molar da solução:
![]()
Juntando-se as duas leis pela proporcionalidade mútua, obtém-se:
![]()
Sabendo-se que
logo a equação (I) fica:
![]()
Onde:
k – constante universal dos gases perfeitos (R);
![]() ou
ou
![]()
p = Pressão osmótica da solução (atm ou mmHg);
V = Volume da solução (litros);
n = Quantidade em mols do soluto;
T = Temperatura absoluta da solução (kelvin).
Saiba mais sobre.....
O Processo de Dessalinização

As usinas de dessalinização em Abu Dhabi também produzem eletricidade
Dessalinizadores funcionam segundo o princípio de osmose reversa. Esse fenômeno, conhecido dos cientistas desde o fim do século passado, passou a ser aplicado em processos industriais na década de 60. desde a década de 80, o emprego de membranas semipermeáveis sintéticas em aplicações industriais passou a se difundir, ampliando o campo de aplicação deste processo. Isto resulta em contínuas reduções de custo, não só pela maior escala de produção permitida como também pelo crescente conhecimento tecnológico adquirido. Nos anos recentes, os avanços científicos no campo de indústria de microchips e da biotecnologia provocaram uma demanda por água de elevada pureza. Por outro lado, a consciência de preservação do meio ambiente da sociedade implica também tratamentos de rejeitos industriais mais sofisticados e de maior eficiência. Nestes campos a osmose reversa tem se desenvolvido bastante. A escassez de água potável em muitas regiões do planeta também determina uma demanda por processos de dessalinização seguros e econômicos. Assim, o processo de dessalinização por osmose reversa tem se difundido, seus custos vêm decrescendo e sendo colocados até ao alcance do indivíduo, viabilizando muitos projetos antes impensáveis.
Membrana Semipermeável
Membranas semipermeáveis são membranas existentes na natureza que têm a capacidade de deixar passar somente um líquido (a água), ou solvente, mas não deixam passar sais nela dissolvidos. Na verdade, o que se verifica é uma propriedade seletiva, isto é, o solvente água passa de um lado para o outro da membrana com muito mais facilidade do que os solutos (sais) existentes.
As paredes das células dos seres vivos são membranas semipermeáveis naturais, regulando a passagem de sais e nutrientes para dentro da célula ou para fora dela.
Os cientistas descobriram que existem membranas sintéticas que exibem a mesma propriedade. Talvez a mais comum delas seja o acetato de celulose, aquele papel transparente que costuma envolver os maços de cigarro. Com uma folha de acetato de celulose pode-se efetuar uma experiência de osmose, fenômeno descrito a seguir.
Osmose
Osmose é uma palavra adicionada aos nossos dicionários desde o final do século passado. A palavra vem do grego (osmós) e significa “impulso”. Popularmente, os estudantes caracterizam a tentativa de “aprender por osmose” como a prática de andar com um livro debaixo do braço. A brincadeira conceitua bem o fenômeno: o conhecimento (a essência) seria absorvido, ficando as páginas do livro.
A osmose natural ocorre quando duas soluções salinas de concentrações diferentes encontram-se separadas por uma membrana semipermeável. Neste caso, a água (solvente) da solução menos concentrada tenderá a passar para o lado da solução de maior salinidade. Com isto, esta solução mais concentrada, ao receber mais solvente, se dilui, num processo impulsionado por uma grandeza chamada “pressão osmótica”, até que as duas soluções atinjam concentrações iguais.
Para melhor entender o fenômeno, recorre-se ao pequeno aparato exibido abaixo: um vaso dividido ao meio por uma membrana semipermeável.
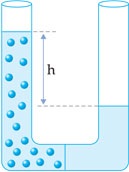
A água do lado direito do vaso tende a passar para o lado esquerdo, aumentando o nível da solução; a diferença de altura h corresponde à pressão osmótica.
Osmose Reversa
A osmose reversa ocorre quando se aplica uma pressão no lado da solução mais salina ou concentrada, revertendo-se a tendência natural. Neste caso, a água da solução salina passa para o lado da água pura, ficando retidos os íons dos sais nela dissolvidos.
A pressão a ser aplicada equivale a uma pressão maior do que a pressão osmótica característica da solução.
Dessalinizadores
 São
equipamentos destinados a produzir água potável a partir de água do mar ou
salobra, empregando o processo de osmose reversa e membranas osmóticas
sintéticas. As condições de trabalho de um dessalinizador são bastante
severas, pois aliam um elemento altamente corrosivo (íon cloreto) a altas
pressões (5 600 a 16 800 atm).
São
equipamentos destinados a produzir água potável a partir de água do mar ou
salobra, empregando o processo de osmose reversa e membranas osmóticas
sintéticas. As condições de trabalho de um dessalinizador são bastante
severas, pois aliam um elemento altamente corrosivo (íon cloreto) a altas
pressões (5 600 a 16 800 atm).
Classificação de uma Solução quanto à Natureza do Soluto
– Uma solução é a mistura homogênea de um soluto em um solvente;
– em uma solução molecular, todas as partículas dissolvidas são moléculas; o soluto não sofre ionização. Exemplo: solução aquosa de açúcar comum, sacarose, C12H22O11;
– em uma solução iônica, há íons em solução; as partículas dissolvidas são íons provenientes da dissolução de um sólido iônico ou da ionização de uma substância molecular. Exemplos: solução aquosa de sal de cozinha (NaCl); solução aquosa de ácido sulfúrico (H2SO4);

A
água e o açúcar A água e o sal de
formam uma solução cozinha
formam uma
molecular : não há solução iônica : há
íons em solução. íons em solução

Como as propriedades coligativas dependem apenas do número de partículas de soluto, e não de sua natureza, temos que, numa solução iônica, os efeitos coligativos são mais intensos que na solução molecular de mesma concentração.
Soluções Iônicas
São aquelas que possuem íons como partículas do soluto. Observe que uma solução iônica não tem necessariamente apenas íons dissolvidos. Uma solução iônica pode apresentar também moléculas dissolvidas.
Sendo assim, o número de partículas de soluto existentes na solução vai depender:
– do número de íons presentes em cada fórmula do composto;
– do grau de dissociação ou ionização (a) desse composto a uma dada temperatura.
Exemplo
Considere o ácido sulfúrico, H2SO4(aq), com grau de ionização a = 61% ou 0,61 a 18°C.
A ionização de uma molécula de H2SO4 é dada pela equação:
![]()
Se considerarmos 100 moléculas de H2SO4, nas condições descritas, temos:
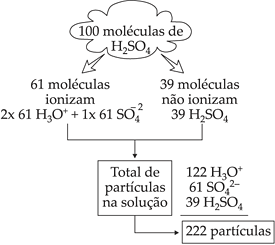
Isto significa que cada 100 moléculas de H2SO4 dissolvidas em água dão origem a 222 partículas em solução.
O cientista holandês Jakobus Henricus Van’t Hoff, por volta de 1882, percebeu que o número de partículas, em solução iônica, poderia ser calculado pelo produto do número de partículas dissolvidas por um certo fator i que, em sua homenagem, é conhecido como fator de correção de Van’t Hoff.
Nº de partículas em solução = Nº de partículas dissolvidas . i
Observe no nosso exemplo:
222 = 100 · i
![]() onde:
onde:
![]()
Van’t Hoff demonstrou que o fator de correção (i) podia ser calculado pela relação:
![]()
Onde:
a = grau de ionização ou dissociação do composto;
q = no total de íons liberados na ionização de 1 molécula ou na dissociação de 1 agregado iônico.
Como vimos, o soluto iônico apresenta um número de partículas maior e, conseqüentemente, o efeito coligativo será mais acentuado.
Portanto, torna-se necessário, então, corrigir as equações, introduzindo um fator corretivo de Van't Hoff (i).
Então temos:
Efeito coligativo = K . W . i
onde:
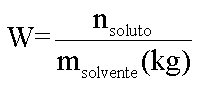
i = 1 + α . (q - 1)
Deste modo, as fórmulas referentes ao efeitos coligativos para solutos iônicos são:
Tonoscopia
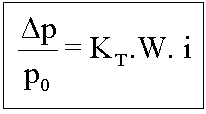
Ebulioscopia
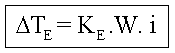
Criscopia
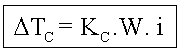
Osmoscopia
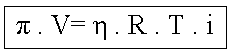
|
||||||||||||||||||||||||||||||||||||||
Este site foi atualizado em 04/03/19