![]() HIDROCARBONETOS
HIDROCARBONETOS![]()
Petróleo: principal fonte de hidrocarbonetos
São compostos orgânicos constituídos exclusivamente de carbono (C) e hidrogênio (H). Em função do tipo de ligação existente entre os carbonos, os hidrocarbonetos são divididos em várias classes, como veremos a seguir.
ÌNDICE
São hidrocarbonetos de cadeia aberta ou alifática e saturada, ou seja, com ligações simples.
O termo parafinas vem do latim: parum=pequena + affinis=afinidade, o que significa compostos pouco reativos.



NOMENCLATURA
Exemplos:
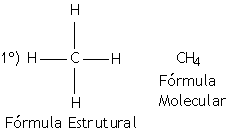
|
Prefixo: MET (1 átomo de carbono) | |
|
Intermediário: AN (ligação simples entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: MET+AN+O = METANO |
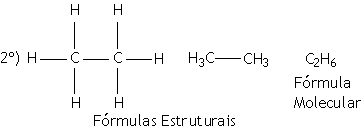
|
Prefixo: ET (2 átomos de carbono) | |
|
Intermediário: AN (ligação simples entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: ET+AN+O = ETANO |
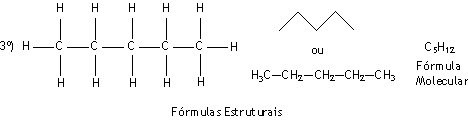
|
Prefixo: PENT (5 átomos de carbono) | |
|
Intermediário: AN (ligação simples entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: PENT+AN+O = PENTANO |
Observe as fórmulas dos seguintes alcanos:
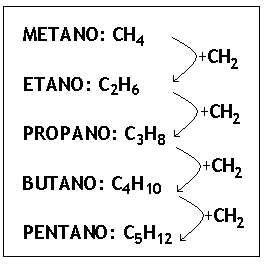
Note que os compostos acima diferem entre si por um grupo (CH2), por isso constituem uma série de compostos denominados de homólogos.
Nos exemplos citados acima observe na tabela abaixo a relação do número de átomos de carbono em relação ao número de átomos de hidrogênio:
| NOME | FÓRMULA MOLECULAR | Nº DE CARBONOS | Nº DE HIDROGÊNIOS |
| METANO | CH4 | 1 | 4 |
| ETANO | C2H6 | 2 | 6 |
| PROPANO | C3H8 | 3 | 8 |
| BUTANO | C4H10 | 4 | 10 |
| PENTANO | C5H12 | 5 | 12 |
Observe que o número de átomos de hidrogênio é sempre igual ao dobro do número de átomos de carbono acrescido de duas unidades, ou seja, para n carbonos, o número de hidrogênios será 2n + 2.
Desta forma, deduzimos que a fórmula geral dos alcanos é CnH2n + 2. Esta fórmula é utilizada para determinar a fórmula molecular de qualquer alcano, desde que tenhamos conhecimento do número de átomos de carbono ou hidrogênio.
Por exemplo: determine a fórmula molecular de um alcano com 25 átomos de carbono.
Dados:
Fórmula Geral dos Alcanos: CnH2n + 2
Número de átomos de carbono: n = 25
Resolução:
para n = 25, teremos o número de átomos de hidrogênio dado pela relação 2n + 2, neste caso ficamos com:
2n + 2 = 2 . (25) + 2 = 50 + 2 = 52
Com isso a fórmula molecular do alcano ficou: C25H52
São hidrocarbonetos de cadeia aberta ou alifática e insaturada, ou seja, que apresenta uma dupla ligação.
O termo olefinas vem do latim: oleum=óleo + affinis=afinidade, o que significa compostos com aspecto oleoso.

Etileno: responsável pelo amadurecimento das frutas.
NOMENCLATURA
Exemplos:
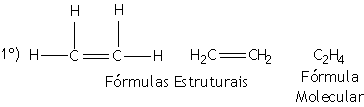
|
Prefixo: ET (2 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: ET+EN+O = ETENO (etileno = nomenclatura usual) |
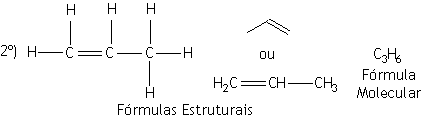
|
Prefixo: PROP (3 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: PROP+EN+O = PROPENO |
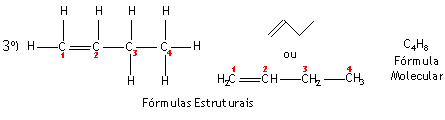
|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
localização da insaturação: entre carbono 1 e 2 | |
|
Nome: 1-BUT+EN+O = 1-BUTENO |
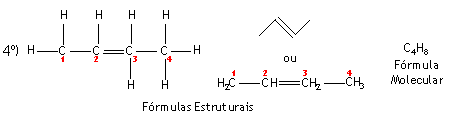
|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Localização da insaturação: entre carbono 2 e 3 | |
|
Nome: 2-BUT+EN+O = 2-BUTENO |
Nos dois exemplos acima descritos, note que o buteno pode apresentar-se com a ligação dupla em duas posições. Neste caso há a necessidade de numerar a cadeia principal a partir da extremidade mais próxima da ligação dupla. A posição da ligação dupla é indicada usando o número do primeiro átomo de carbono da dupla. Na sua nomenclatura, o número que indica a posição da ligação dupla, precede o nome, então ficamos com: 1-buteno e 2-buteno.
Observe na tabela abaixo a relação do número de átomos de carbono em relação ao número de átomos de hidrogênio:
| NOME | FÓRMULA MOLECULAR | Nº DE CARBONOS | Nº DE HIDROGÊNIOS |
| ETENO | C2H4 | 2 | 4 |
| PROPENO | C3H6 | 3 | 6 |
| 1-BUTENO | C4H8 | 4 | 8 |
| 1-PENTENO | C5H10 | 5 | 10 |
| 1-HEXENO | C6H12 | 6 | 12 |
Observe que o número de átomos de hidrogênio é sempre igual ao dobro do número de átomos de carbono, ou seja, para n carbonos, o número de hidrogênios será 2n.
Desta forma, deduzimos que a fórmula geral dos alcenos é CnH2n. Esta fórmula é utilizada para determinar a fórmula molecular de qualquer alceno, desde que tenhamos conhecimento do número de átomos de carbono ou hidrogênio.
São hidrocarbonetos de cadeia aberta ou alifática e insaturada por uma tripla ligação.

Acetileno: constitui a chama obtida nos maçaricos que pode alcançar a temperatura de 2800° C.
NOMENCLATURA
Exemplos:
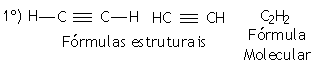
|
Prefixo: ET (2 átomos de carbono) | |
|
Intermediário: IN (ligação tripla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: ET+IN+O = ETINO (acetileno = nomenclatura usual) |
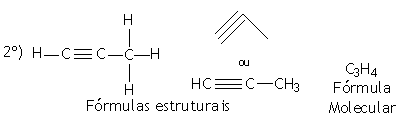
|
Prefixo: PROP (3 átomos de carbono) | |
|
Intermediário: IN (ligação tripla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: PRO+IN+O = PROPINO |
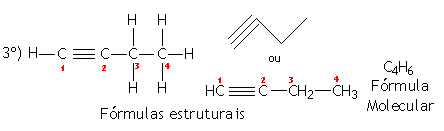
|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: IN (ligação tripla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Localização da insaturação: entre carbono 1 e 2 | |
|
Nome: 1-BUT+IN+O = 1-BUTINO |
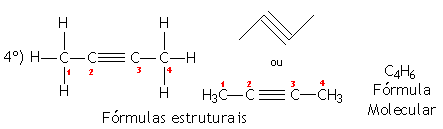
|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: IN (ligação tripla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Localização da insaturação: entre carbono 2 e 3 | |
|
Nome: 2-BUT+IN+O = 2-BUTINO |
Observe na tabela abaixo a relação do número de átomos de carbono em relação ao número de átomos de hidrogênio:
| NOME | FÓRMULA MOLECULAR | Nº DE CARBONOS | Nº DE HIDROGÊNIOS |
| PROPINO | C3H4 | 3 | 4 |
| 1-BUTINO | C4H6 | 4 | 6 |
| 1-PENTINO | C5H8 | 5 | 8 |
| 1-HEXINO | C6H10 | 6 | 10 |
Observe que o número de átomos de hidrogênio é sempre igual ao dobro do número de átomos de carbono menos 2 unidades, ou seja, para n carbonos, o número de hidrogênios será 2n - 2.
Desta forma, deduzimos que a fórmula geral dos alcinos é CnH2n - 2. Esta fórmula é utilizada para determinar a fórmula molecular de qualquer alcino, desde que tenhamos conhecimento do número de átomos de carbono ou hidrogênio.
Observação
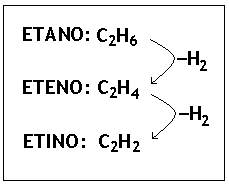
Note que os compostos acima diferem entre si por um grupo (H2), por isso constituem uma série de compostos denominados de isólogos.
São hidrocarbonetos de cadeia aberta ou alifática e insaturada por duas ligações duplas.

Butadieno: constituinte de borrachas sintéticas.
NOMENCLATURA
Exemplos:
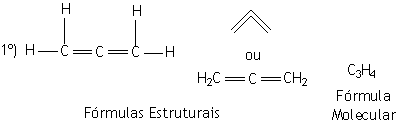
|
Prefixo: PROP (3 átomos de carbono) | |
|
Intermediário: DIEN (2 ligações duplas entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: PROP+DIEN+O = PROPADIENO |
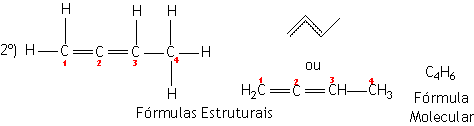
|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: DIEN (2 ligações duplas entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Localização das insaturações: entre carbono 1 e 2 - 2 e 3 | |
|
Nome: 1,2-BUT+DIEN+O = 1,2-BUTADIENO |
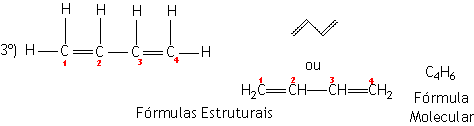
|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: DIEN (2 ligações duplas entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Localização das insaturações: entre carbono 1 e 2 - 3 e 4 | |
|
Nome: 1,3-BUT+DIEN+O = 1,3-BUTADIENO |
Observe na tabela abaixo a relação do número de átomos de carbono em relação ao número de átomos de hidrogênio:
| NOME | FÓRMULA MOLECULAR | Nº DE CARBONOS | Nº DE HIDROGÊNIOS |
| PROPADIENO | C3H4 | 3 | 4 |
| 1,2-BUTADIENO | C4H6 | 4 | 6 |
| 1,3-PENTADIENO | C5H8 | 5 | 8 |
| 1,5-HEXADIENO | C6H10 | 6 | 10 |
Observe que o número de átomos de hidrogênio é sempre igual ao dobro do número de átomos de carbono menos 2 unidades, ou seja, para n carbonos, o número de hidrogênios será 2n - 2.
Desta forma, deduzimos que a fórmula geral dos alcadienos é CnH2n - 2. Esta fórmula é utilizada para determinar a fórmula molecular de qualquer alcadieno, desde que tenhamos conhecimento do número de átomos de carbono ou hidrogênio.
CICLOALCANOS, CICLOPARAFINAS OU CICLANOS
São hidrocarbonetos de cadeia fechada do tipo alicíclica saturada.
Ciclopropano: anestésico potente.
NOMENCLATURA
Exemplos:

|
Prefixo: PROP (3 átomos de carbono) | |
|
Intermediário: AN (ligação simples entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO PROP+AN+O = CICLOPROPANO |

|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: AN (ligação simples entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO BUT+AN+O = CICLOBUTANO |
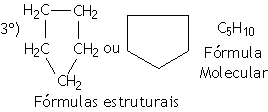
|
Prefixo: PENT (5 átomos de carbono) | |
|
Intermediário: AN (ligação simples entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO PENT+AN+O = CICLOPENTANO |
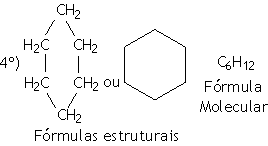
|
Prefixo: HEX (6 átomos de carbono) | |
|
Intermediário: AN (ligação simples entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO HEX+AN+O = CICLOHEXANO |
Observe na tabela abaixo a relação do número de átomos de carbono em relação ao número de átomos de hidrogênio:
| NOME | FÓRMULA MOLECULAR | Nº DE CARBONOS | Nº DE HIDROGÊNIOS |
| CICLOPROPANO | C3H6 | 3 | 6 |
| CICLOBUTANO | C4H8 | 4 | 8 |
| CICLOPENTANO | C5H10 | 5 | 10 |
| CICLOHEXANO | C6H12 | 6 | 12 |
Observe que o número de átomos de hidrogênio é sempre igual ao dobro do número de átomos de carbono, ou seja, para n carbonos, o número de hidrogênios será 2n.
Desta forma, deduzimos que a fórmula geral dos cicloalcanos é CnH2n. Esta fórmula é utilizada para determinar a fórmula molecular de qualquer cicloalcano, desde que tenhamos conhecimento do número de átomos de carbono ou hidrogênio.
CICLOALCENOS, CICLOALQUENOS OU CICLENOS
São hidrocarbonetos de cadeia fechada do tipo alicíclica insaturada por uma ligação dupla.

MCP (metil ciclopropeno): conservante de flores pois inibe o etileno, facilitando o transporte e comercialização.
NOMENCLATURA
Exemplos:

|
Prefixo: PROP (3 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO PROP+EN+O = CICLOPROPENO |

|
Prefixo: BUT (4 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO BUT+EN+O = CICLOBUTENO |
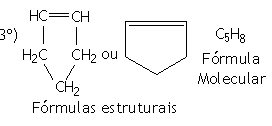
|
Prefixo: PENT (5 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO PENT+EN+O = CICLOPENTENO |
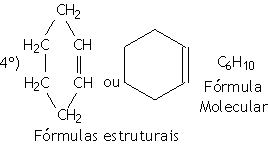
|
Prefixo: HEX (6 átomos de carbono) | |
|
Intermediário: EN (ligação dupla entre carbonos) | |
|
Sufixo: O (função: hidrocarboneto) | |
|
Nome: CICLO HEX+EN+O = CICLOHEXENO |
Observe na tabela abaixo a relação do número de átomos de carbono em relação ao número de átomos de hidrogênio:
| NOME | FÓRMULA MOLECULAR | Nº DE CARBONOS | Nº DE HIDROGÊNIOS |
| CICLOPROPENO | C3H4 | 3 | 4 |
| CICLOBUTENO | C4H6 | 4 | 6 |
| CICLOPENTENO | C5H8 | 5 | 8 |
| CICLOHEXENO | C6H10 | 6 | 10 |
Observe que o número de átomos de hidrogênio é sempre igual ao dobro do número de átomos de carbono menos 2 unidades, ou seja, para n carbonos, o número de hidrogênios será 2n - 2.
Desta forma, deduzimos que a fórmula geral dos cicloalcenos é CnH2n - 2. Esta fórmula é utilizada para determinar a fórmula molecular de qualquer cicloalceno, desde que tenhamos conhecimento do número de átomos de carbono ou hidrogênio.
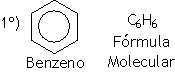
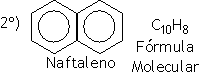
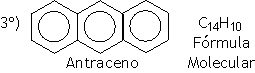
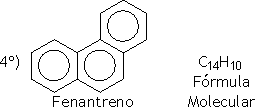
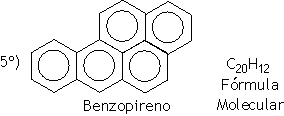
São hidrocarbonetos que apresentam pelo menos um anel benzênico em sua estrutura.
Não possuem fórmula geral e sua nomenclatura não segue as regras utilizadas nos outros hidrocarbonetos.

Fumaça do cigarro: rica em compostos aromáticos cancerígenos tais como benzeno, benzopireno,antraceno, fenatreno, tolueno entre outros.
Exemplos:
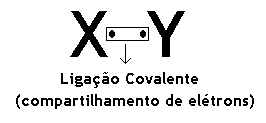
Considere uma molécula genérica do tipo XY, onde os átomos estão ligados entre si por uma ligação covalente, isto é, por um compartilhamento de elétrons, ligação mais comum nos compostos orgânicos.
Se fornecermos uma determinada quantidade de energia à ligação covalente, esta poderá ser quebrada (cisão) de duas formas diferentes:
1º) CISÃO HOMOLÍTICA (HOMÓLISE)
Neste caso a quebra da ligação faz com que cada átomo fique com um dos elétrons do par eletrônico que estava sendo compartilhado.
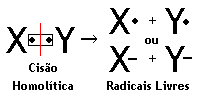
Note que na cisão homolítica os átomos ficam com elétrons livres, isto é, não compartilhados, originando espécies químicas muito reativas denominadas de radicais livres, que podem ser representados por um traço (X- ou Y-).
2º) CISÃO HETEROLÍTICA OU HETERÓLISE
Neste caso a quebra da ligação faz com que um dos átomos fique com o par eletrônico que estava sendo compartilhado.
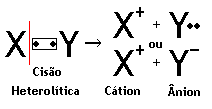
Observe que na cisão heterolítica o átomo X perdeu elétrons transformando-se no íon cátion e o átomo Y ganhou um elétron transformando-se no íon ânion.
RADICAIS ORGÂNICOS
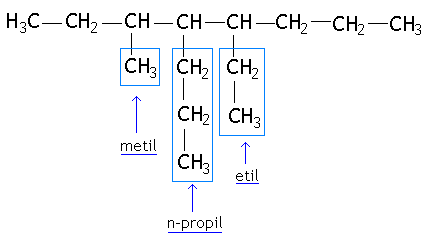
Os radicais orgânicos são obtidos através de uma cisão homolítica da ligação entre carbono e hidrogênio. A nomenclatura dos radicais orgânicos é caracterizada pelo sufixo IL ou ILA, precedidos do prefixo que indica a quantidade de átomo de carbono. Os radicais provenientes dos alcanos são denominados de alquilas e os provenientes dos aromáticos são denominados de arila.
Exemplos:
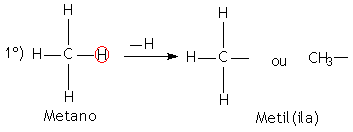
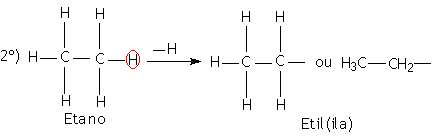
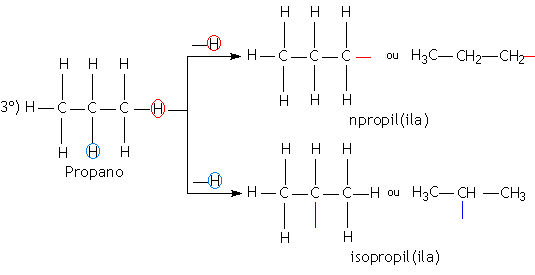
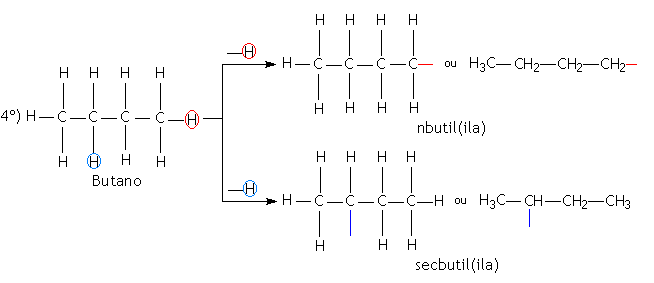
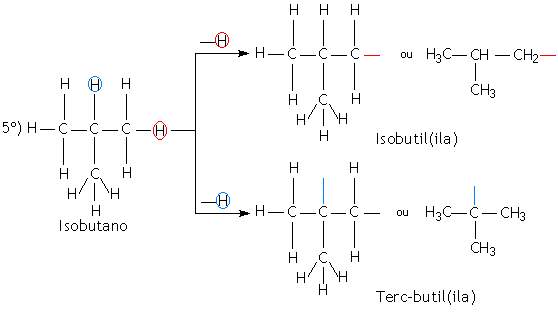
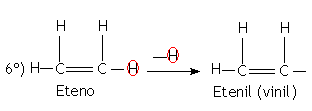
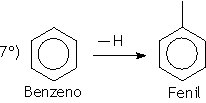
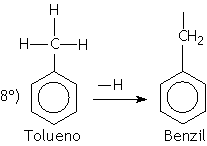
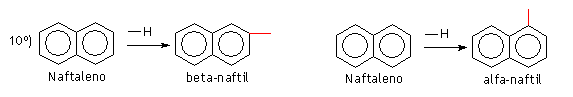
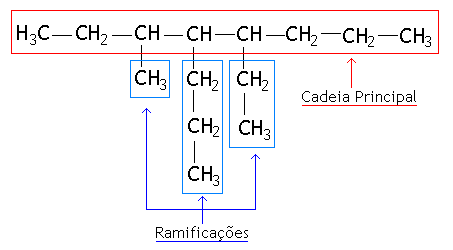
NOMENCLATURA DE HIDROCARBONETOS RAMIFICADOS
HIDROCARBONETOS ALIFÁTICOS SATURADOS
REGRAS DE NOMENCLATURA SEGUNDO A IUPAC
1º) Determinar a cadeia principal.
Cadeia principal é a maior seqüência de átomos de carbono, que não estão necessariamente representados em linha reta. Caso existam duas seqüências de átomos de carbono, utiliza-se como cadeia principal a que possuir maior número de ramificações.
2º) Reconhecer os radicais orgânicos correspondentes às ramificações e nomeá-los.
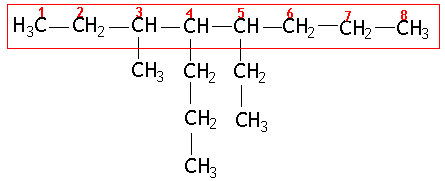
3º) NUMERAR A CADEIA PRINCIPAL.
A numeração deve iniciar da extremidade da cadeia que permita dar às ramificações os menores números possíveis.
4º) INDICAR A POSIÇÃO DOS RADICAIS.
Se houver dois ou mais radicais iguais, usar os prefixos di, tri, tetra, etc., para indicar a quantidade. Os nomes dos radicais são separados por hífen.
Quando houver dois ou mais tipos de radicais diferentes, seus nomes podem ser escritos de duas maneiras:
|
Pela ordem de complexidade, crescente dos radicais; | |
|
Pela ordem alfabética (notação recomendada pela IUPAC). |
5º) ESCREVER O NOME DO HIDROCARBONETO CORRESPONDENTE À CADEIA PRINCIPAL.
Veja como fica o nome do composto citado nos exemplos acima:
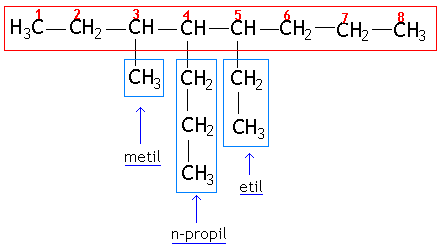
|
Cadeia principal: octano (8 átomos de carbono) | |
|
Radicais: metil, n-propil, etil | |
|
Posições (menores valores): metil = 3, n-propil = 4, etil = 5 | |
|
Nome do composto por ordem de complexidade: 3-metil-5-etil-4-n-propil-octano | |
|
Nome do composto por ordem alfabética (IUPAC): 5-etil-3-metil-4-n-propil-octano |
HIDROCARBONETOS ALIFÁTICOS INSATURADOS
Quanto às regras de nomenclatura, a única diferença em relação aos alcanos é que as insaturações devem obrigatoriamente fazer parte da cadeia principal e receber os menores valores possíveis.
ALCENOS
A cadeia principal deve conter a dupla ligação característica dos alcenos e apresentar o maior número de átomos de carbono possível.
Exemplo:
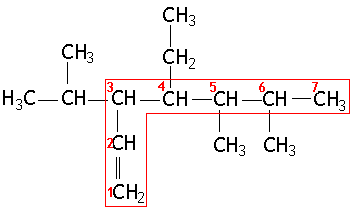
|
Cadeia principal: 1-hepteno (7 átomos de carbono) | |
|
Radicais: isopropil, etil, metil, metil (dimetil) | |
|
Posições (menores valores): , iso-propil = 3, etil = 4, metil = 5, metil = 6 | |
|
Nome do composto por ordem de complexidade: 5.6-dimetil-4-etil-3-isopropil-1-hepteno | |
|
Nome do composto por ordem alfabética (IUPAC): 4-etil-5,6-dimetil-3-isopropil-1-hepteno |
ALCINOS
A cadeia principal deve conter a tripla ligação característica dos alcinos e apresentar o maior número de átomos de carbono possível.
Exemplo:
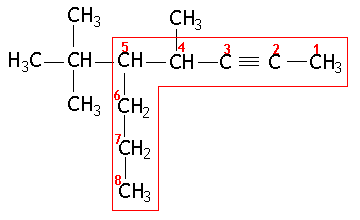
|
Cadeia principal: 2-octino (8 átomos de carbono) | |
|
Radicais: metil e terc-butil. | |
|
Posições: , metil = 4, terc-butil = 5 | |
|
Nome do composto por ordem de complexidade: 4-metil-5-terc-butil-2-octino | |
|
Nome do composto por ordem alfabética (IUPAC): 5-terc-butil-4-metil-2-octino |
ALCADIENOS
A cadeia principal deve conter a tripla ligação característica dos alcinos e apresentar o maior número de átomos de carbono possível.
Exemplo:
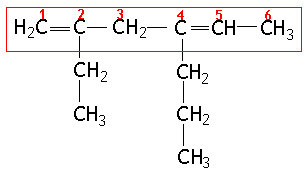
|
Cadeia principal: 1,4-hexadieno (6 átomos de carbono) | |
|
Radicais: etil e n-propil. | |
|
Posições: , etil = 2, n-propil = 4 | |
|
Nome do composto por ordem de complexidade: 2-etil-4-n-propil-1,4-hexadieno | |
|
Nome do composto por ordem alfabética (IUPAC): 2-etil-4-n-propil-1,4-hexadieno |
HIDROCARBONETOS CÍCLICOS
Nos hidrocarbonetos cíclicos, é considerada cadeia principal aquela que apresenta ciclo ou anel.
CICLOALCANOS
A nomenclatura da cadeia principal é feita de acordo com as regras utilizadas para os cicloalcanos.
a) Com um radical: citar o nome do radical sem a necessidade de indicar a posição e o nome da cadeia.
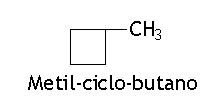
b) Com mais de um radical: a numeração da cadeia se inicia a partir da ramificação mais simples e segue-se o sentido horário ou anti-horário, de maneira a se respeitar a regra dos menores números. No nome do composto as ramificações devem ser citadas em ordem alfabética.
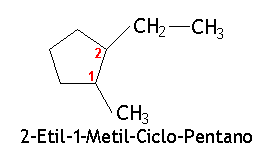
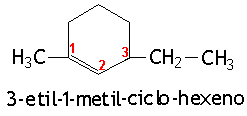
CICLOALCENOS
A nomenclatura da cadeia principal deve ser iniciada sempre por um dos carbonos da dupla ligação, de modo que ela fique localizada entre os carbonos 1 e 2. O sentido da numeração é determinado pela regra dos menores números. No nome do composto as ramificações devem ser citadas em ordem alfabética.
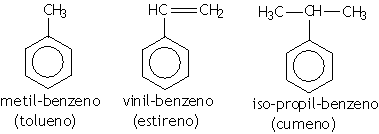
AROMÁTICOS
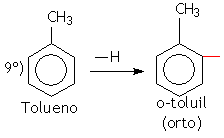
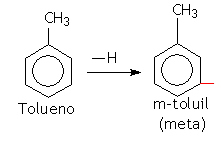
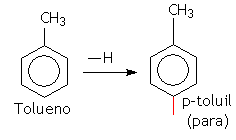
Os aromáticos são considerados como derivados do benzeno. Nos aromáticos de um único anel benzênico, havendo apenas um radical, não é preciso numeração. Havendo dois ou mais radicais no benzeno, a numeração deve partir da ramificação mais simples e seguir o sentido dos menores números.
Exemplos:
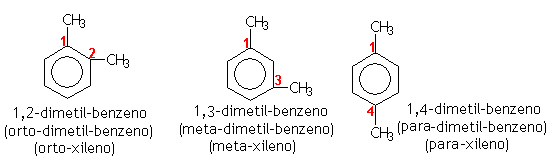
Quando existirem dois radicais no benzeno, só haverá três posições possíveis: 1 e 2 (prefixo orto), 1 e 3 (prefixo meta) e 1 e 4 (prefixo para).
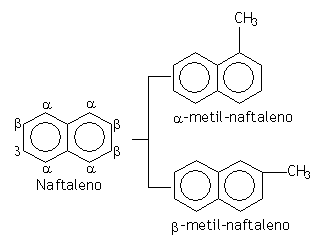
Quando uma molécula de naftaleno possui um radical, este pode ocupar duas posições diferentes: alfa e beta.
Este site foi atualizado em 11/03/09