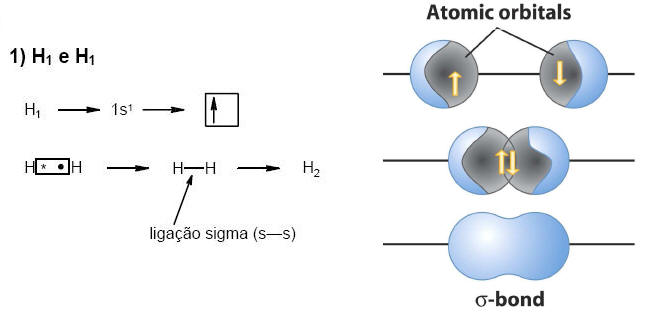
A ligação covalente sob o ponto de vista dos orbitais moleculares.
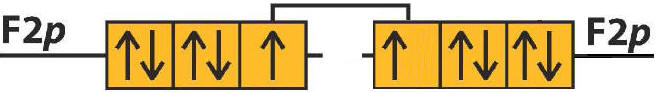
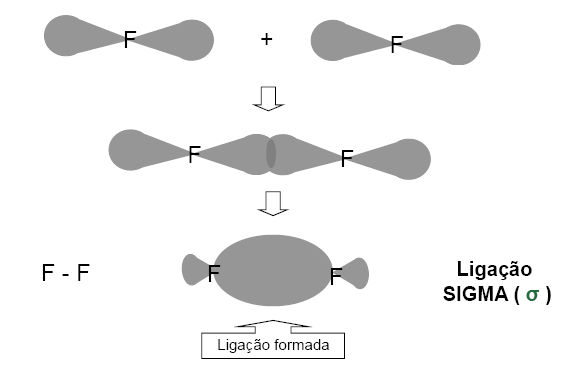
2) 9F e 9F
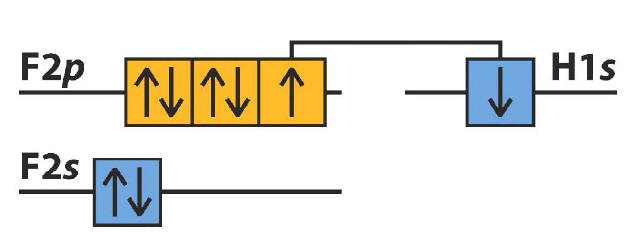
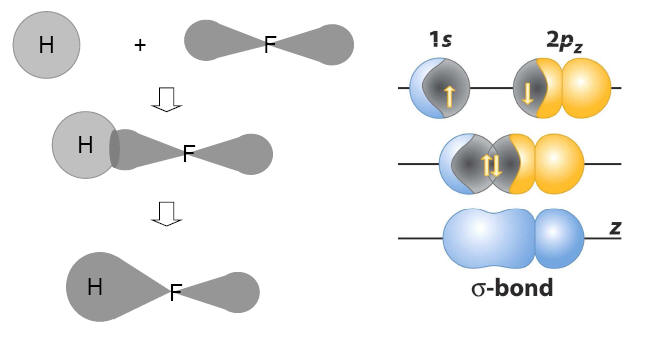
3) 1H e 9F
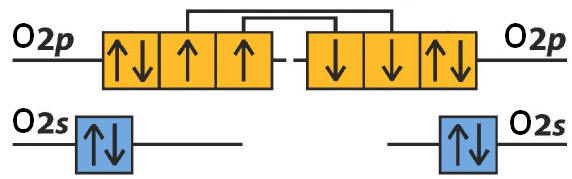
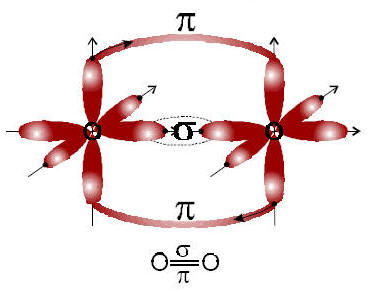
4) 8O e 8O
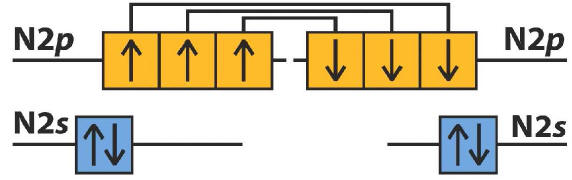
5) 7N e 7N
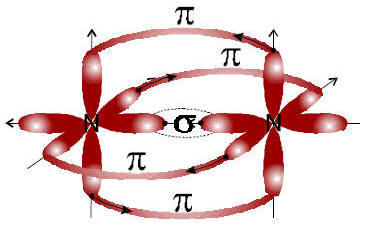
Com os exemplos descritos acima, podemos fazer duas importantes observações:
I)
• Ligação Simples (-): ligação
σ.• Ligação Dupla (=): uma
σ e uma π .• Ligação Tripla (≡): uma
σ e duas πII) Cada ligação covalente (orbital molecular) é proveniente de um orbital atômico incompleto.
HIBRIDAÇÃO
1) BeH2 → H - Be - H (Dado: 4Be e 1H)
Como podemos observar na molécula do BeH2 o berílio faz duas ligações covalentes e o hidrogênio faz uma ligação covalente. Desta forma podemos esperar que o hidrogênio tenha um orbital atômico incompleto e o berílio tenha dois orbitais atômicos incompletos para poder formar a molécula do BeH2, certo?
4Be → 1s2 2s2
1H → 1s1
No entanto, o berílio não possui nenhum orbital atômico incompleto para se ligar ao hidrogênio, como explicar então as duas ligações covalentes da molécula do BeH2?
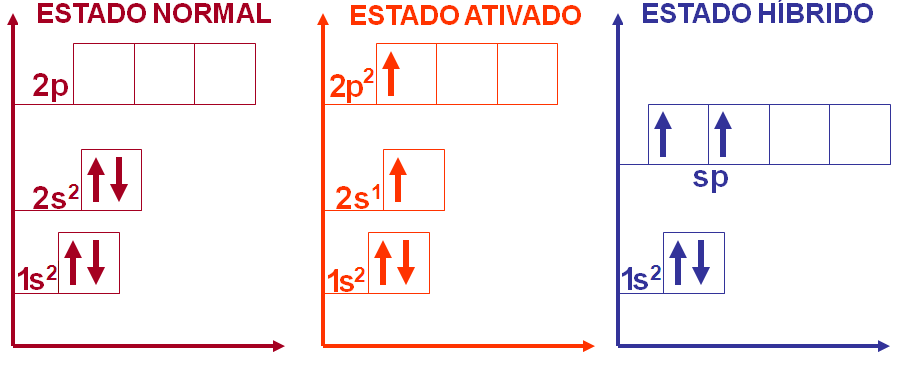

Neste caso, na molécula do BeH2 temos o berílio com hibridação sp apresentando geometria linear com ângulo formado entre os ligantes de 180o.
2) BH3 (Dado: 5B e 1H)
Como podemos observar na molécula do BH3 o boro faz três ligações covalentes e o hidrogênio faz uma ligação covalente. Desta forma podemos esperar que o hidrogênio tenha um orbital atômico incompleto e o boro tenha três orbitais atômicos incompletos para poder formar a molécula do BH3, certo?
5B → 1s2 2s2 3s1
1H → 1s1
No entanto, o boro possui apenas um orbital atômico incompleto para se ligar ao hidrogênio, como explicar então as três ligações covalentes da molécula do BH3?
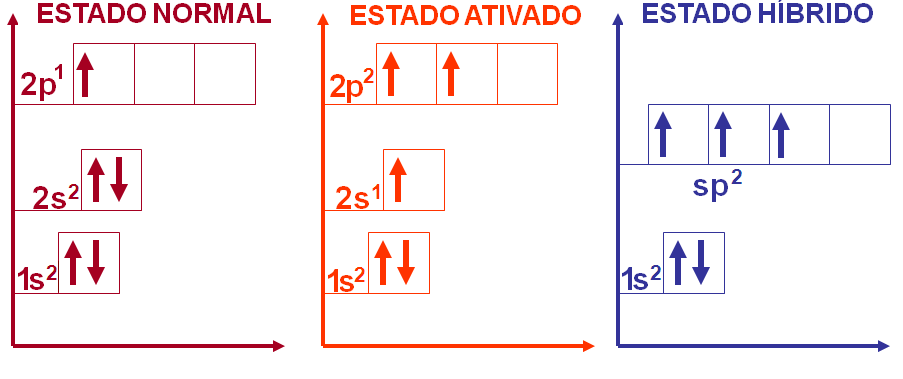
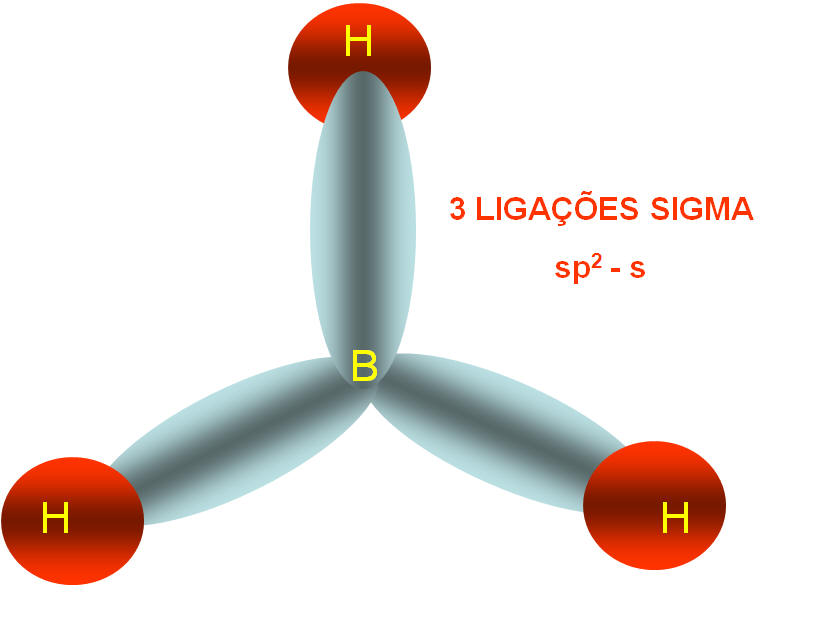
Neste caso, na molécula do BH3 temos o boro com hibridação sp2 apresentando geometria trigonal plana (triangular) com ângulo formado entre os ligantes de 120o
3) CH4 (Dado: 6C e 1H)
Como podemos observar na molécula do CH4 o carbono faz quatro ligações covalentes e o hidrogênio faz uma ligação covalente. Desta forma podemos esperar que o hidrogênio tenha um orbital atômico incompleto e o carbono tenha quatro orbitais atômicos incompletos para poder formar a molécula do CH4, certo?
6C → 1s2 2s2 2p2
1H → 1s1
No entanto, o carbono possui dois orbitais atômicos incompletos para se ligar ao hidrogênio, como explicar então as quatro ligações covalentes da molécula do CH4?
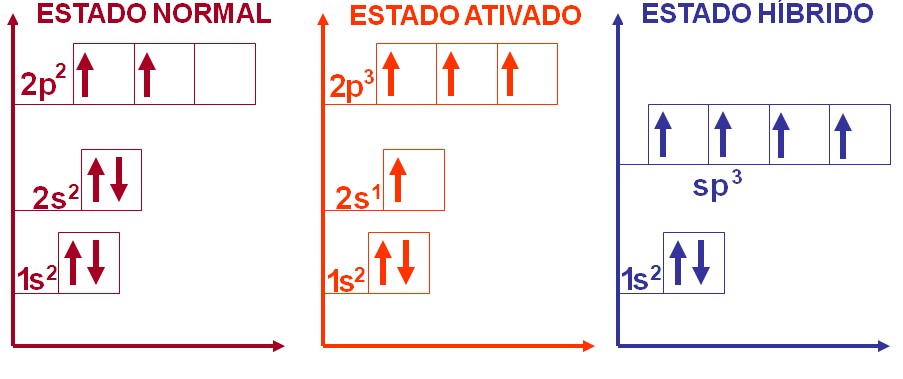
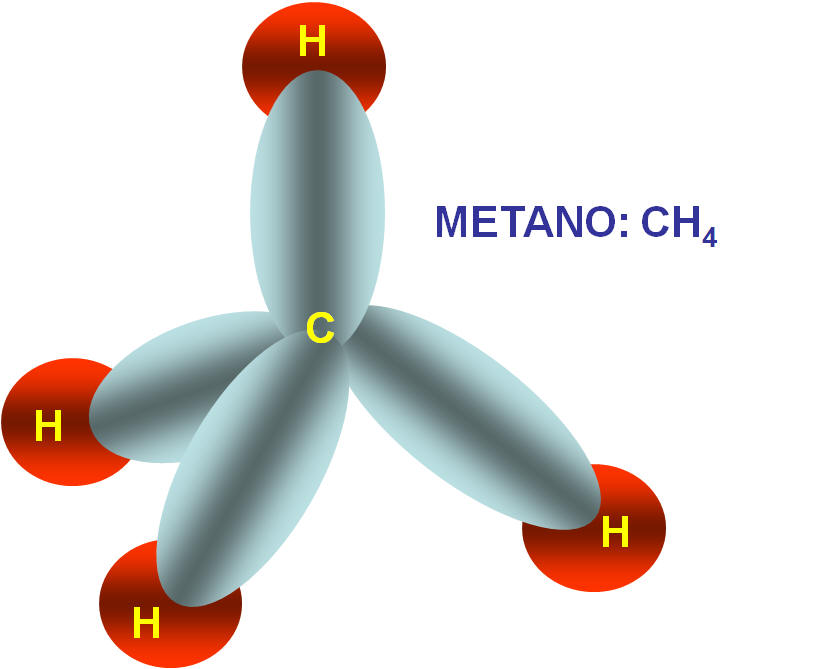
Neste caso, na molécula do CH4 temos o carbono com hibridação sp3 apresentando geometria tetraédrica com ângulo formado entre os ligantes de 109o28'.
4) C2H4 (Dado: 6C e 1H)
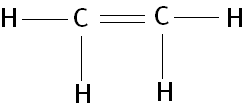
Na fórmula estrutural do eteno podemos notar que cada átomo de carbono possui 3 ligações sigma e uma ligação pi, como sabemos que estas ligações possuem energias diferentes como então explicar a hibridação do carbono.
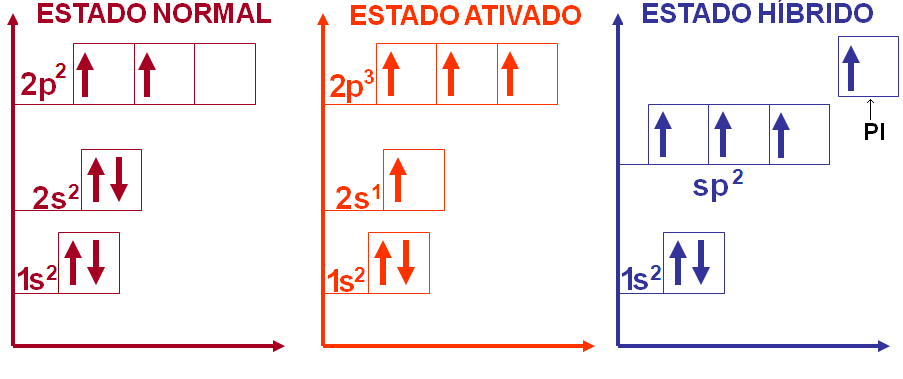
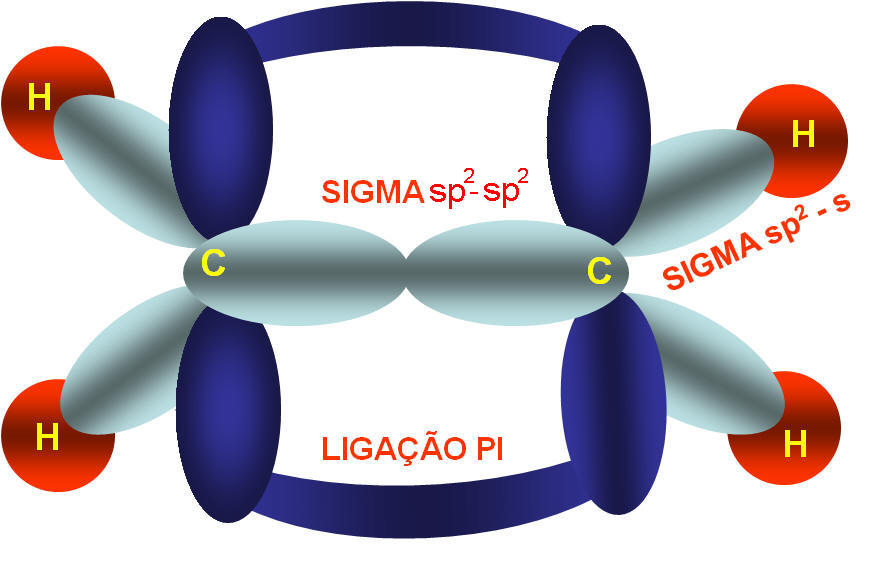
Portanto, na molécula do eteno temos o carbono com hibridação sp2 apresentando geometria trigonal plana (triangular) com ângulo formado entre os ligantes de 120o
5) C2H2 (Dado: 6C e 1H)
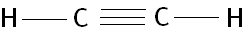
Na fórmula estrutural do acetileno podemos notar que cada átomo de carbono possui 2 ligações sigma e duas ligações pi, como sabemos que estas ligações possuem energias diferentes como então explicar a hibridação do carbono.
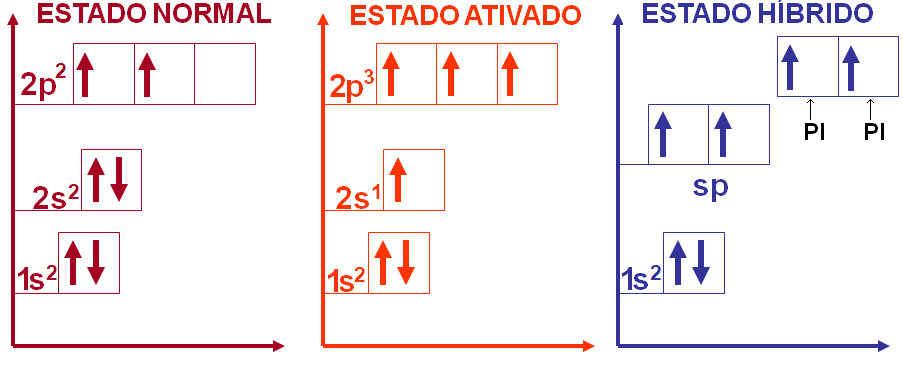
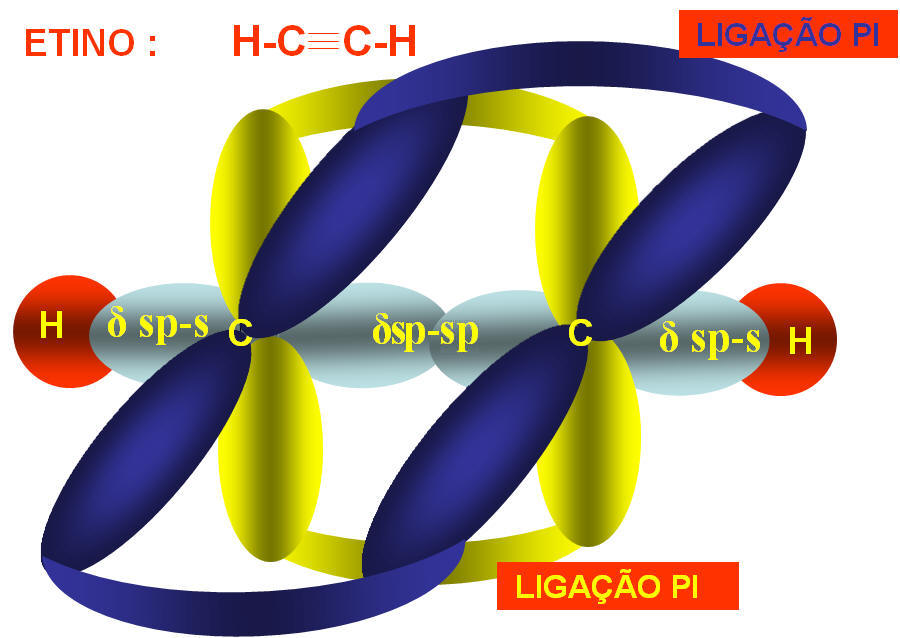
Portanto, na molécula do acetileno temos o carbono com hibridação sp apresentando geometria linear com ângulo formado entre os ligantes de 180o.
Resumindo temos:
|
Hibrida-ção |
Elementos |
Ângulo |
Geometria |
Orbitais híbridos |
|
sp3 |
Família 14, C com simples ligações. |
109°28’ |
Tetraédrica |
4 |
|
sp2 |
Família 13 (B,Aℓ) C com 1 dupla. |
120° |
Trigonal Plana |
3 |
|
sp |
Berílio, C com 2 duplas ou 1 tripla. |
180° |
Linear |
2 |
Este site foi atualizado em 04/03/19