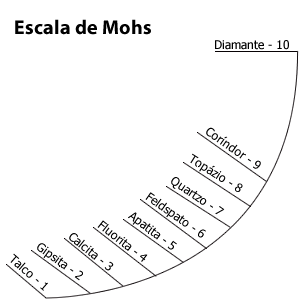
| Dureza | Mineral | Fórmula química |
|---|---|---|
| 1 | Talco, (pode ser arranhado facilmente com a unha) | Mg3Si4O10(OH)2 |
| 2 | Gipsita (ou Gesso), (pode ser arranhado com unha com um pouco mais de dificuldade) | CaSO4·2H2O |
| 3 | Calcita, (pode ser arranhado com uma moeda de cobre) | CaCO3 |
| 4 | Fluorita, (pode ser arranhada com uma faca de cozinha) | CaF2 |
| 5 | Apatita, (pode ser arranhada dificilmente com uma faca de cozinha) | Ca5(PO4)3(OH-,Cl-,F-) |
| 6 | Feldspato / Ortoclásio, (pode ser arranhado com uma liga de aço) | KAlSi3O8 |
| 7 | Quartzo, (capaz de arranhar o vidro. Ex.: Ametista) | SiO2 |
| 8 | Topázio, (Capaz de arranhar o quartzo) | Al2SiO4(OH-,F-)2 |
| 9 | Corindon, (Capaz de arranhar o Topázio) | Al2O3 |
| 10 | Diamante, (Mineral mais duro que existe, pode arranhar qualquer outro e é arranhado apenas por outro diamante ) | C |
ÍNDICE
MATÉRIA E SUAS PROPRIEDADES
MATÉRIA
Tudo em que você puder pensar, destas páginas que você está lendo até a cadeira que você está sentado, a água que você bebe, tudo é feito de matéria. Mas a matéria não é apenas uma coisa que você pode tocar. Inclui o ar que se respira. Os planetas no Universo, seres vivos e inanimados, insetos e rochas. Tudo é feito de matéria.
Portanto definimos matéria como tudo aquilo que possui massa e que por sua vez ocupa lugar no espaço.
Toda matéria é constituída de pequenas partículas chamadas átomos, que por sua vez são formadas de partícula ainda menores, chamadas partículas subatômicas.
A Química envolve o estudo da matéria e do que ela é feita, e como os átomos se unem para formar materiais diferentes.
CRIAÇÃO DA MATÉRIA: COMO TUDO REALMENTE ACONTECEU
Muitos cientistas acreditam que toda matéria foi criada em uma explosão chamada Big Bang, que produziu muito calor e energia. Algumas dessas porções dessa energia transformaram-se em pequenas partículas. As partículas reuniram-se em átomos que formaram todo o Universo em que vivemos.

Big Bang
Muitas teorias são tão criativas que se assemelham às mais fantasiosas narrativas de ficção científica. A teoria do Big-Bang, um modelo para explicar a formação do Universo, é um bom exemplo dessa criatividade.
Em 1929, o astrônomo norte-americano Edwin Hubble propôs, a partir de algumas evidências experimentais, que o Universo estaria em expansão. Um balão de borracha sendo inflado seria um modelo modesto dessa expansão que estaria ocorrendo com todos os corpos celestes.
Por volta de 1950, o astrônomo ucraniano George Gamov sugeriu uma explicação fantástica. Segundo ele, o Universo, como conhecemos, seria o resultado de uma vasta explosão inicial, que foi chamada de Big-Bang. As galáxias e todos os demais corpos celestes seriam "fragmentos" dessa explosão. Em 1965, dois físicos norte-americanos, Arrio Penzias e Robert Wilson, detectaram misteriosas radiações eletromagnéticas que parecem reforçar a hipótese do Big-Bang. Mas não devemos estranhar se novos fatos, ou diferentes interpretações de dados já conhecidos, alterarem o modelo do Big-Bang. Afinal, podemos perceber que nunca saberemos realmente corno tudo começou.
EXISTE ALGO QUE NÃO SEJA MATÉRIA?
No espaço sideral, onde se movimentam os corpos celestes, o meio é o vácuo que significa ausência de matéria. O vácuo também pode ser obtido em laboratório, com instrumentos especiais.
PARA SABER MAIS
Os passos para a antimatéria
Nos princípios do século XX, os físicos começaram a compreender que toda a matéria é constituída de certos tipos de partículas. Mas somente em 1930 o físico Paul Dirac estabeleceu que todo tipo de partícula tinha que ter seu correspondente oposto.
Em 1932, o norte-americano Anderson descobriu o positron (antielétron), a primeira antipartícula cientificamente detectada.
Em 1956, a equipe de Segre (um italiano naturalizado norte-americano) conseguiu produzir artificialmente antiprótons e antinêutrons, que constituem o núcleo do átomo.

Em 1971, para surpresa dos norte-americanos, a Agência Tass, da Ex-União Soviética, informou que cientistas russos haviam conseguido obter formalmente, pela primeira vez, a antimatéria, usando imensas quantidades de energia. A descoberta se deve a uma equipe orientada pelo físico Prochkin.
Em 1978, os italianos fizeram uma nova experiência: geraram antiprótons e mantiveram-nos “presos” durante 85 horas em um intenso campo magnético. Com isso, conseguiram aumentar o período de vida de uma antipartícula produzida em laboratório, até então era um décimo milionésimo de segundo ou cem mil microssegundos.
A antimatéria pode vir a ser uma fonte incalculável de energia para o futuro.
Há cálculos que indicam que a energia liberada por 35 miligramas de antimatéria é suficiente para colocar em órbita um ônibus espacial do tamanho da Challenger, que atualmente usa como combustível 2 mil toneladas de hidrogênio líquido.
(Folha de S. Paulo, dezembro de 1978)
Finalmente está pronta a antimatéria
Em setembro de 1996, uma equipe do Cern, Centro Europeu de Pesquisa Nuclear, em Genebra, Suíça, montou o primeiro átomo de antimatéria. Era um “anti-hidrogênio”, que equivale ao hidrogênio comum, o mais simples dos elementos químicos. O núcleo do antiátomo não era um próton normal, de carga elétrica positiva, mas um antipróton, de carga negativa. À volta do núcleo havia um antielétron, positivo, em lugar de um elétron normal, negativo. Atenção: alguns disseram que a antimatéria tinha sido descoberta em 1996. Besteira pura. Ela é conhecida desde os anos 30, de 32 exatamente, mas apenas na forma de partículas subatômicas. Só no ano passado se construiu um antiátomo inteiro.
(Revista Superinteressante, janeiro de 1997)
Com um pedaço de madeira um marceneiro faz uma mesa. Com uma barra de ouro, um ouvires faz uma pulseira. O pedaço de madeira e a barra de ouro são exemplos de corpos. A mesa e a pulseira são exemplos de objetos. Desta forma, podemos definir:
CORPO
É qualquer porção limitada de matéria
OBJETO
É um corpo trabalhado e que tem alguma utilidade.
Relacionando os exemplos acima com matéria, podemos afirmar que:
Madeira ® tábua ® mesa
(matéria) (corpo) (objeto)
Ouro ® barra de ouro ® pulseira
(matéria) (corpo) (objeto)

A ENERGIA é que faz as coisas acontecerem: um raio em dia de tempestade ou o simples ato de amarrar os cordões do sapato. Os animais usam energia para andar e correr; as plantas usam para crescer. Os ventos são energia; as ondas e marés, correndo através do oceano, também. E quando um carro anda, ele usa energia armazenada no combustível. Nada disso aconteceria se não houvesse forças trabalhando. Sempre que a energia é usada, há forças envolvidas. Força é sempre necessária para fazer as coisas se moverem, ou mudar como que elas se movem e, claro para imobilizá-las. Ela também é responsável por separar coisas ou colocá-las juntas. Sem forças nem energia, nada aconteceria no Universo. O Sol fornece a maior, parte da energia conhecida na Terra, na forma de luz. Chega mais energia do Sol à Terra em uma hora do que aquela que se poderia consumir em um ano. As plantas precisam de energia do Sol para crescer; e muitos animais comem plantas e aproveitam essa energia armazenada.

Praticar windsurf envolve o uso de forças e energia. Os praticantes usam sua própria energia para controlar a prancha e saltar sobre as ondas. A energia do vento cria a força que impulsiona a vela. Se houver forças demais um uma mesma direção, a prancha pode virar. Os windsurfistas precisam, portanto, exercer sua força contra o vento para, desse modo, equilibrar tudo e se manter na onda.
Se uma lâmina de zinco for analisada as suas propriedades (dureza, condutividade, brilho, etc), dizemos que a lâmina de zinco é o sistema em estudo, e todo o universo ao seu redor é chamado de meio ambiente (ou ambiente externo ou ambiente). Entre o sistema em análise e o meio ambiente existem fronteiras de separação bem definidas. No exemplo citado, o meio ambiente é o ar que envolve o sistema (lâmina de zinco), e a fronteira de separação é a própria lâmina de zinco.
Portanto definindo sistema ficamos com:
Sistema é qualquer porção limitada de matéria a ser submetida a um estudo.
CLASSIFICAÇÃO DOS SISTEMAS
Sistema é classificado em função da capacidade de trocar matéria e energia com o meio ambiente.
Sistema aberto: tem a capacidade de trocar tanto matéria quanto energia com o meio ambiente.
Sistema fechado: tem a capacidade de trocar somente energia com o meio ambiente.
Sistema isolado: não troca matéria nem energia com o meio ambiente. A rigor, não existe nenhum sistema completamente isolado.
Ex.: um exemplo aproximado desse tipo de sistema é a garrafa térmica, normalmente usada para conservar a energia térmica dos líquidos. No entanto, mesmo as melhores garrafas térmicas existentes trocam energia com o meio ambiente por não serem perfeitamente isoladas.
|
Tipos de Sistemas
|
||||
|
Sistema Aberto
|
Sistema Fechado
|
Sistema Isolado
|
||
 |
 |
 |
||
|
O Sistema efetua trocas de energia e de matéria com o exterior.
|
O Sistema efetua trocas de energia com o exterior, mas não
efetua trocas de matéria.
|
O Sistema não efetua trocas de energia nem de matéria com o
exterior.
|
||
PROPRIEDADES DA MATÉRIA
As panelas não são feitas de aço e plástico por acaso. O cabo é de plástico porque ele é um bom isolante de calor – evita que o cabo fique muito quente e queime sua mão. A panela é de aço, bom condutor, para deixar o calor chegar até o alimento. Bom isolamento ou boa condutividade são exemplos de uma específica propriedade da matéria. Algumas propriedades, como a condutividade, podem ser medidas. Outras, como o cheiro de um objeto, podem ser apenas descritas. Os cientistas medem as propriedades de muitos materiais diferentes. Eles fazem isso à temperatura e pressão do ambiente para que se possa fazer comparações precisas.
As propriedades da matéria podem ser divididas em 3 grupos: gerais, funcionais e específicas.
São aquelas que podemos observar em qualquer espécie de matéria.
As principais são:
MASSA
Medida da quantidade de matéria que existe num corpo.
No início a massa era avaliada pela estimativa da carga que um ser humano ou um animal poderia levantar ou carregar (medida subjetiva). Posteriormente, passou a ser obtida por meio do uso de balanças (medida objetiva). Essa utilização já era comum por volta de 2000 a.C., e esse progresso foi, sem dúvida, provocado pela intensificação do comércio.


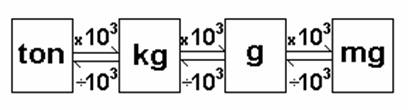
Na antiguidade, as unidades de massa variavam de uma região para outra, o que trazia muita confusão. Com o passar do tempo, levou-se uma uniformização, e hoje o padrão adotado, pelo Sistema Internacional (SI), em quase todos os países é o quilograma e seus múltiplos e submúltiplos (toneladas, gramas, miligramas, etc.).
EXTENSÃO (VOLUME)
Lugar no espaço ocupado pela matéria.
 Desde
a antiguidade, jarros e vasilhas foram utilizados como unidades de medida
para comercializar líquidos como o vinho, o leite, etc. É o caso da ânfora
dos romanos, equivalente a aproximadamente 25,44 litros. Curiosamente, até o
século XIX era comum, no interior do Brasil, a compra e venda de arroz,
feijão, milho, etc. em litros, já que as balanças eram raras e custavam
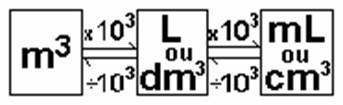
caro. Atualmente, a unidade oficial, estabelecido pelo Sistema Internacional
(SI), é o metro cúbico (m3). No entanto, a unidade mais usada é o
litro (L) e também o centímetro cúbico (cm3). Além disso, também
persistem unidades antigas, como por exemplo tintas são vendidas em galões.
Desde
a antiguidade, jarros e vasilhas foram utilizados como unidades de medida
para comercializar líquidos como o vinho, o leite, etc. É o caso da ânfora
dos romanos, equivalente a aproximadamente 25,44 litros. Curiosamente, até o
século XIX era comum, no interior do Brasil, a compra e venda de arroz,
feijão, milho, etc. em litros, já que as balanças eram raras e custavam
caro. Atualmente, a unidade oficial, estabelecido pelo Sistema Internacional
(SI), é o metro cúbico (m3). No entanto, a unidade mais usada é o
litro (L) e também o centímetro cúbico (cm3). Além disso, também
persistem unidades antigas, como por exemplo tintas são vendidas em galões.
IMPENETRABILIDADE
 Você
já tentou colocar dois objetos no mesmo lugar? Ou um ficará ao lado do outro
ou por cima ou na frente, mas nunca exatamente no mesmo lugar. Fazer com que
ambos ocupem o mesmo espaço é totalmente impossível, pois duas porções de
matéria não podem ocupar o mesmo lugar no espaço no mesmo tempo.
Você
já tentou colocar dois objetos no mesmo lugar? Ou um ficará ao lado do outro
ou por cima ou na frente, mas nunca exatamente no mesmo lugar. Fazer com que
ambos ocupem o mesmo espaço é totalmente impossível, pois duas porções de
matéria não podem ocupar o mesmo lugar no espaço no mesmo tempo.
Às vezes parece que essa propriedade não é válida. Quando dissolvemos açúcar no café, por exemplo, temos a impressão que ambos passam a ocupar o mesmo lugar. Mas isso, não é verdade: enchendo uma xícara de café até a borda, observamos que, à medida que o açúcar é colocado, o nível do café sobe e ele transborda.
DIVISIBILIDADE
 Com
o auxílio de um martelo, podemos reduzir a pó um pedaço de giz, de grafite,
de granito, de madeira, etc. Isso é possível porque a matéria pode ser
dividida em pequenas partículas. Da mesma forma, com um gota de anilina
podemos tingir a água contida num copo. Isso ocorre porque a anilina tem a
propriedade de dividir-se em partículas muito pequenas, que se espalham pela
água.
Com
o auxílio de um martelo, podemos reduzir a pó um pedaço de giz, de grafite,
de granito, de madeira, etc. Isso é possível porque a matéria pode ser
dividida em pequenas partículas. Da mesma forma, com um gota de anilina
podemos tingir a água contida num copo. Isso ocorre porque a anilina tem a
propriedade de dividir-se em partículas muito pequenas, que se espalham pela
água.
Toda matéria pode ser dividida sem alterar a sua constituição, até um limite máximo ao qual chamamos de átomo.
COMPRESSIBILIDADE
Se você empurrar o êmbolo de uma seringa de injeção com o orifício de saída tapado, vai perceber que o êmbolo empurra até certo ponto o ar contido na seringa. Isso aconteceu porque o ar ao ser comprimido tem o seu volume reduzido.

Portanto podemos definir compressibilidade como capacidade da matéria se submetida à ação de forças externas (pressão), o volume ocupado pode diminuir.
Dependendo do tipo de matéria, a compressão pode ser maior ou menor. O ar, por exemplo, é altamente compressível; já a água se comprime muito pouco.
Desta forma temos:
Os gases são facilmente comprimidos.
Os líquidos são comprimidos até um certo ponto.
Nos sólidos quase não se percebe a compressão.

Esquema mostrando como funciona o elevador de automóvel e a direita: a força do ar comprimido é utilizado em elevadores de automóvel.
ELASTICIDADE
Continuando com o exemplo dado acima, depois de comprimir o ar dentro da seringa e mantendo o orifício de saída tapado, quando soltamos o êmbolo, o ar retoma o volume que tinha antes da compressão.

 Desta
forma podemos definir elasticidade como uma propriedade em que a matéria,
dentro de um certo limite, se submetida à ação de uma força causando
deformação, ela retornará à forma original, assim que essa força deixar de
agir. Isto ocorre porque seus espaços interatômicos e intermoleculares
diminuem ou aumentam.
Desta
forma podemos definir elasticidade como uma propriedade em que a matéria,
dentro de um certo limite, se submetida à ação de uma força causando
deformação, ela retornará à forma original, assim que essa força deixar de
agir. Isto ocorre porque seus espaços interatômicos e intermoleculares
diminuem ou aumentam.
INDESTRUTIBILIDADE

Quando um pedaço de lenha é queimado, os materiais que fazem parte da composição da madeira se transformam em cinza e fumaça. Essa transformação mostra que não houve destruição da matéria, mas sim a transformação em outra matéria. Desta forma podemos concluir que a matéria não pode ser criada nem destruída, apenas transformada. E esse fato, que é um dos princípios básicos da Química, se deve à característica de indestrutibilidade da matéria.
São propriedades comuns a determinados grupos de matérias, identificadas pela função que desempenham. Exemplos: ácidos, bases, sais, óxidos, álcoois, éter, etc.

.jpg)

Ácidos: vinagre = solução de ácido acético; limão = contém ácido cítrico e ácido ascórbico; bateria = contém solução de ácido sulfúrico.



Bases: leite de magnésia = suspensão aquosa de hidróxido de magnésio; soda cáustica = contém hidróxido de sódio; detergente = contém hidróxido de amônio.



Sais: sal de cozinha = constituído fundamentalmente de cloreto de sódio; adubo = mistura de sais de fósforo entre eles o fosfato de cálcio; bicarbonato de sódio = sal usado como antiácido estomacal.


Óxidos: extintor = existem vários tipos de extintores, sendo os mais comuns os de gelo seco (gás carbônico); cal = óxido de cálcio.
Além das propriedades gerais que acabamos de estudar, a matéria apresenta outras propriedades, como cor, brilho e sabor. O sal, por exemplo, apresenta sabor, já a água destilada não. Portanto, as propriedades que são características de cada substância se denominam propriedades específicas da matéria.
São classificadas em: físicas, químicas e organolépticas.
PROPRIEDADES FÍSICAS
São propriedades que caracterizam fisicamente a matéria. As propriedades físicas importantes são: os pontos de fusão, solidificação, ebulição e liquefação da matéria; a condutividade; o magnetismo; a solubilidade; a dureza; a maleabilidade; a ductibilidade; a densidade; o calor específico.
PONTOS DE FUSÃO E SOLIDIFICAÇÃO
São as temperaturas nas quais a matéria passa da fase sólida para a fase líquida e da fase líquida para a fase sólida respectivamente, sempre em relação a uma determinada pressão atmosférica.

fusão: o ferro transformando-se em líquido

Solidificação: a água transformando-se em sólido
PONTOS DE EBULIÇÃO E CONDENSAÇÃO
São as temperaturas nas quais a matéria passa da fase líquida para a fase gasosa e da fase gasosa para a líquida respectivamente, sempre em relação a uma determinada pressão atmosférica.

ebulição: quando a água começa a ferver.

Condensação ou liquefação: as gotículas de água no vidro embaçado.
CONDUTIVIDADE
Certas matérias conduzem bem o calor e a eletricidade, como é o caso dos metais. O mesmo não acontece com outras substâncias, como o iodo, a água e o fósforo, que se apresentam resistentes na condução do calor e da eletricidade.



Usos do cobre: o cobre é um bom condutor de calor e eletricidade. Por isso, é utilizado para fazer utensílios de cozinha e para canos de água quente em residências e indústrias. Também serve para diferentes equipamentos elétricos, como fios condutores de eletricidade e bobinas de motores. O cobre não oxida facilmente por isso possui alta duração.
MAGNETISMO
Quando uma determinada matéria tem a propriedade de atrair o ferro, significa que ela apresenta propriedade magnética. Um exemplo de substância magnética natural é a magnetita (pedra imã natural), um minério de ferro.

Imã atraindo prego e limalha de ferro.
DUREZA
É a resistência que uma espécie de matéria apresenta ao ser riscada por outra.
Quanto maior a resistência ao risco, mais dura é a matéria.
Escala de dureza de Mohs
Friedrich Mohs, um mineralogista alemão, criou uma tabela de dez minerais, com dureza relativa. Quanto mais alto o número, mais duro o mineral. Os minerais de valores numéricos altos (6, 7, 8) riscam os de valores relativos mais baixos (1, 2, 3, 4)
O diamante é a matéria mais dura que se conhece, é utilizado em brocas que cortam o mármore e em estiletes de cortar vidro.
Existem vários tipos de diamantes, uns mais valiosos que outros. Só os mais caros são empregados na fabricação de jóias. Depois de lapidado, o diamante recebe o nome de brilhante.
O maior diamante já encontrado no mundo foi o Cullinan, procedente da África do Sul. Sua massa era de 3106 quilates (cerca de 620 gramas). O maior diamante encontrado no Brasil foi de 726 quilates (aproximadamente 150 gramas). O peso de um diamante é expresso em quilates. Um quilate, que é dividido em 100 pontos, equivale a 200 mg.
Obs.: você não deve confundir dureza (resistência ao risco) com a tenacidade (resistência ao impacto). Por exemplo: se você der uma martelada sobre um diamante, ele se despedaçará. Mas, se a martelada for sobre um pedaço de ferro, o máximo que poderá acontecer é ficar a marca do martelo sobre o ferro. Agora, se você passar o diamante sobre uma chapa de ferro, ficará um risco.
Conclusão
O diamante é mais duro que o ferro.
O ferro é mais tenaz que o diamante.
MALEABILIDADE
A matéria que pode ser facilmente transformada em lâminas é considerada maleável. Exemplos: ferro, alumínio, prata, ouro e chumbo.


Artesanato em ferro e madeira
DUCTIBILIDADE
É a propriedade que permite a matéria ser transformada em fio. É o que acontece com os metais: os fios de cobre, por exemplo, são usados para conduzir a eletricidade que chega em nossa casa.

Por ser um bom condutor de eletricidade, o cobre é usado como fio que conecta os aparelhos as tomadas
BRILHO
 É
a capacidade que a matéria possui em refletir a luz que incide sobre ela.
Quando a matéria não reflete a luz, ou reflete muito pouco, dizemos que ela
não tem brilho. Uma matéria que não possui brilho, não é necessariamente
opaca e vice-versa. Matéria opaca é aquela que não deixa atravessar a luz.
Assim, uma barra de ouro é brilhante e opaca, pois reflete a luz sem se
deixar atravessar por ela.
É
a capacidade que a matéria possui em refletir a luz que incide sobre ela.
Quando a matéria não reflete a luz, ou reflete muito pouco, dizemos que ela
não tem brilho. Uma matéria que não possui brilho, não é necessariamente
opaca e vice-versa. Matéria opaca é aquela que não deixa atravessar a luz.
Assim, uma barra de ouro é brilhante e opaca, pois reflete a luz sem se
deixar atravessar por ela.
CALOR ESPECÍFICO
É a quantidade de calor necessária para aumentar em 1 grau Celsius (1oC) a temperatura de 1 grama de massa de qualquer matéria. Por exemplo, o que demoraria mais para ferver, 1 litro de água (que tem 1000 g de massa) ou 2 litros de água (que tem 2000 g de massa)? Logicamente, 1 litro de qualquer substância ferve antes que dois litros, pois seu volume é menor. Mas, em ambos os casos, o calor específico é o mesmo, ou seja, 1 cal/g 0C.
Veja alguns valores que indicam o calor específico medidos à 15oC:
Água: 1,000 cal/goC); álcool etílico: 0,540 cal/goC; alumínio: 0,215 cal/goC; ferro: 0,110 cal/goC; zinco: 0,093 cal/goC.
Construindo um calorímetro

Calorímetro
O calorímetro é um instrumento utilizado para medir a quantidade de calor, fazer análises das trocas de calor que acontecem entre dois corpos localizados em seu interior, e ainda determinar o calor específico de um determinado elemento, que pode ser, por exemplo, o cobre. Esse equipamento é muito utilizado nos laboratórios de ensino quando se deseja realizar as análises citadas anteriormente. Ele pode ser comprado, como também confeccionado. Com materiais simples e do cotidiano dos alunos o professor de física pode instruir os alunos na confecção desse instrumento, a fim de fazer análises das quantidades de calor trocadas neste sistema isolado termicamente, ou seja, livre de trocas de calor com o meio ambiente.
Para construir um calorímetro, proceda da seguinte forma: pegue um recipiente de isopor que possua tampa bem ajustada, ou seja, que não possua folgas entre a tampa e as paredes do recipiente. Dentro deste último coloque outro recipiente de metal e com um algodão preencha os espaços existentes entre os dois recipientes. Na tampa da embalagem de isopor faça dois pequenos furos, um para o termômetro e outro para o agitador (uma pequena haste metálica, por exemplo). Está pronto o calorímetro.
Para medir a quantidade de calor e descobrir o calor especifico de um determinado material como o ferro, por exemplo, coloque uma determinada massa de água a temperatura de 20 °C dentro do calorímetro. Feito isso, pegue um pequeno pedaço de ferro, meça sua massa e depois aqueça-o até que ele atinja uma temperatura de 60°C. Ainda quente coloque-o dentro do calorímetro contendo água, feche bem e com o agitador agite o sistema para que ele entre em equilíbrio térmico. Sabendo a massa, a temperatura inicial e final da água e do ferro e utilizando a equação fundamental e o princípio da calorimetria, podemos fazer as análises das trocas de calor e descobrir qual é o calor específico do material.
DENSIDADE

Por que os icebergs conseguem boiar na água do mar?
Também chamada de densidade absoluta ou massa específica (d) de um corpo definido como a relação entre a massa do material e o volume por ele ocupado.
Essa definição é expressa da seguinte forma:

onde: m = massa do corpo (kg ou g)
V = volume ocupado pelo corpo (cm3 ou mL e L ou dm3)
D = densidade (kg/L ou g/L ou g/cm3)
Para sólidos e líquidos, a densidade é normalmente expressa em g/cm3, para gases, costuma-se expressar a densidade em g/L.
Quando dizemos que o metal ouro apresenta densidade de 19,3 g/cm3 à 20oC, isso significa que o volume de 1cm3 de ouro possui massa de 19,3 g.
A densidade varia com a temperatura, pois os corpos geralmente dilatam-se (aumentam de volume) com o aumento da temperatura. Quando não se menciona a temperatura, fica subentendido que ela é de 20oC.
SAIBA MAIS
A ESTRELA DE NÊUTRON
 O
metal ósmio é o material mais denso da Terra (d = 22,6 g/cm3): 2
vezes mais denso que o chumbo (d = 11,4 g/cm3) e 22 vezes mais
denso que a água (d = 1 g/cm3 à 4oC)
O
metal ósmio é o material mais denso da Terra (d = 22,6 g/cm3): 2
vezes mais denso que o chumbo (d = 11,4 g/cm3) e 22 vezes mais
denso que a água (d = 1 g/cm3 à 4oC)
Um dos mais densos materiais do Universo é o que constitui uma estrela de nêutron. A cabeça de um alfinete feito de uma estrela de nêutron pesaria um milhão de toneladas.
POR QUE OS CUBOS DE GELO BÓIAM?
Os cubos de gelo que colocamos num copo com água ou com bebida ficam boiando porque a densidade do gelo é menor que a da água. Ou seja, um certo volume de gelo possui massa menor que igual volume de água. Esse fenômeno explica também os icebergs, imensos blocos de gelo que flutuam na água do mar.

Em regiões polares, a presença de grandes blocos de gelo – icebergs - (água pura) é normal, flutuando na água do mar, que possui água e sais dissolvidos. Isto ocorre pois o gelo (d = 0,92 g/cm3) é menos denso que a água do mar (d = 1,03 g/cm3).
BOIAR NO MAR MORTO É MAIS FÁCIL
Por serem demasiadamente salgadas, as águas do mar Morto são mais densas que as de outros mares e oceanos. Sua densidade é de 1,119 g/cm3. Por isso, é praticamente impossível uma pessoa afogar-se nesse mar, pois seu corpo, quando mergulhado na água, recebe um grande empuxo (o corpo mergulhado na água é empurrado para cima com uma força igual ao peso do volume de água que desloca), que o mantém facilmente na superfície.

O mar Morto é assim tão salgado porque há 10.000 anos a capacidade de água que recebe dos rios e das chuvas é muito menor do que a que se evapora. Para se ter uma idéia da escassez de chuvas nessa região, basta comparar o índice de precipitação pluviométrica em São Paulo e na região do mar Morto. Enquanto em São Paulo, muitas vezes, em um dia chove cerca de 100 mm, naquela região a quantidade de chuva fica em torno de 45 mm por ano.
APLICAÇÃO DA DENSIDADE
® DETERMINAÇÃO DA QUALIDADE DO LEITE
 O
leite é constituído de vários materiais dissolvidos na água, apresentando um
valor de densidade característico. A adição de outros materiais ou de água,
altera sua densidade, permitindo verificar por meio do densímetro
apropriado, se houve alguma alteração do produto (uréia dissolvida em água
apresenta um valor de densidade muito próximo ao leite, por isso alguns
fazendeiros inescrupulosos, para aumentar o seu lucro, adicionam uréia ao
leite, quando não utilizam um produto mais barato: a própria urina da vaca).
O
leite é constituído de vários materiais dissolvidos na água, apresentando um
valor de densidade característico. A adição de outros materiais ou de água,
altera sua densidade, permitindo verificar por meio do densímetro
apropriado, se houve alguma alteração do produto (uréia dissolvida em água
apresenta um valor de densidade muito próximo ao leite, por isso alguns
fazendeiros inescrupulosos, para aumentar o seu lucro, adicionam uréia ao
leite, quando não utilizam um produto mais barato: a própria urina da vaca).
® VERIFICAÇÃO DA CARGA DA BATERIA
As baterias dos automóveis possuem ácido sulfúrico em quantidade apropriada, logo com um valor definido de densidade. A medida do valor dessa densidade (feita com densímetro apropriado) indica se a bateria está descarregada ou não.

® VERIFICAÇÃO DA QUALIDADE DO ÁLCOOL COMBUSTÍVEL

Com o densímetro, pode-se conferir a qualidade do álcool pela determinação de sua densidade.
O álcool combustível vendido nos postos de abastecimento contém uma certa quantidade de água (álcool hidratado). Essa mistura é padronizada e apresenta um valor definido de densidade. Ao lado das bombas de álcool existe um recipiente transparente contendo a mistura água/álcool e duas bolinhas de densidades diferentes (uma com densidade um pouco maior que a mistura – que fica no fundo do recipiente – e outra com uma densidade um pouco menor que a mistura – que fica na parte superior do recipiente). Quando a proporção água/álcool é alterada, modifica-se a densidade da mistura, fazendo com que as bolinhas fiquem no mesmo lado (as duas na parte superior ou na parte inferior).

PROPRIEDADES QUÍMICAS
Caracterizam quimicamente os materiais através de reações químicas. Por exemplo:
COMBUSTÃO
Quando a matéria queima (combustível), significa que ela está reagindo com o oxigênio do ar. Essa propriedade se chama combustão. Para que ocorra combustão, é fundamental a presença do oxigênio (comburente).
Um exemplo disso é a queima da vela: se você colocar um copo virado sobre a vela acesa, a chama vai consumir o oxigênio contido no interior do copo e, nesse instante, a vela se apaga.

Assim que acendemos uma vela, observamos a formação de um líquido em seu topo, logo abaixo da chama. De onde veio este líquido? Veio da massa branca, a parafina de que é feito a vela, e que se derreteu sob a ação do calor da chama. O calor da chama também provoca a evaporação desse líquido.
Isto pode ser provado: colocando várias vezes uma faca na horizontal sobre o pavio, notamos que se forma na faca uma película branca e gordurosa, constituída de parafina que voltou a se liquefazer ao entrar em contato com a lâmina mais fria da faca. Esfriando-se um pouco mais, a parafina líquida torna-se sólida.
A chama é portanto produzida pela queima do vapor de parafina proveniente da vela. A parafina líquida sobe pelo pavio, o que torna mais fácil seu contato com o oxigênio, facilitando a combustão.
São as propriedades capazes de impressionar os nossos sentidos, como a cor, que impressiona a visão, o sabor e o odor, que impressionam o paladar e o olfato, respectivamente, e o estado de agregação da matéria (sólido, líquido, pó, pastoso), que impressionam o tato.
Este site foi atualizado em 04/03/19