PROFESSOR
PAULO CESAR
![]() PORTAL DE
ESTUDOS EM QUÍMICA
PORTAL DE
ESTUDOS EM QUÍMICA![]()
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Escala musical |
Elementos |
|
dó |
H, F, Cl, ... |
|
ré |
Li, Na, K, ... |
|
mi |
Be, Mg, Ca, ... |
|
fá |
B, Al, Cr, ... |
|
sol |
C, Si, Ti, ... |
|
lá |
N, P, Mn, ... |
|
si |
O, S, Fe, ... |
No entanto, naquela época, a relação entre música e química foi considerada ridícula, constituindo alvo de muitas críticas e, desta forma, a lei das Oitavas de Newlands, foi desprezada pelos membros da Sociedade de Química de Londres. Somente 20 anos mais tarde, teve o reconhecimento do seu trabalho e o grande mérito de introduzir a idéia da periodicidade para os elementos químicos.
Tabela de Mendeleyev e Meyer
Mendeleyev (esquerda) e Meyer (direita)
Em 1869, o cientista alemão Julius L. Meyer (baseando-se em propriedades físicas) e o cientista russo Dimitri I. Mendeleyev (baseando-se em propriedades químicas), trabalhando independentemente, propuseram tabelas semelhantes para a classificação dos elementos químicos.
Mendeleyev realizou um trabalho mais detalhado, onde verificou através de suas análises que havia uma repetição periódica das propriedades quando os elementos químicos eram colocados em ordem crescente de suas massas atômicas.
Naquela época eram conhecidos cerca de 60 elementos, que foram dispostos em 12 linhas horizontais, em ordem crescente de suas massa atômicas, e na mesma vertical os elementos com propriedades químicas semelhantes, como mostra a tabela a seguir:
|
Série |
Grupo I |
Grupo II |
Grupo III |
Grupo IV |
Grupo V |
Grupo VI |
Grupo VII |
Grupo VIII |
|||||||
|
1 |
|
H 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
Li 7 |
|
Be 9,4 |
|
B 11 |
|
C 12 |
|
N 14 |
|
O 16 |
|
F 19 |
|
|
|
3 |
|
Na 23 |
|
Mg 24 |
|
Al 27,3 |
|
Si 28 |
|
P 31 |
|
S 32 |
|
Cl 35,5 |
|
|
4 |
K 39 |
|
Ca 40 |
|
? 44 |
|
Ti 48 |
|
V 51 |
|
Cr 52 |
|
Mn 55 |
|
Fe-56 Co-59 Ni-59 |
|
5 |
|
Cu 63 |
|
Zn 65 |
|
? 68 |
|
? 72 |
|
As 75 |
|
Se 78 |
|
Br 80 |
|
|
6 |
Rb 85 |
|
Sr 37 |
|
? 88 |
|
Zr 90 |
|
Nb 94 |
|
Mo 96 |
|
? 100 |
|
Ru-104 Rh-104 Pd-106 |
|
7 |
|
Ag 108 |
|
Cd 112 |
|
In 113 |
|
Sn 118 |
|
Sb 122 |
|
Te 128 |
|
I 127 |
|
|
8 |
Cs 135 |
|
Ba 137 |
|
? 138 |
|
? 140 |
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
? 178 |
|
? 180 |
|
Ta 182 |
|
W 184 |
|
|
|
|
|
Os-195 Ir-197 Pt-198 |
|
11 |
|
Au 199 |
|
Hg 200 |
|
Tl 204 |
|
Pb 207 |
|
Bi 208 |
|
|
|
|
|
|
12 |
|
|
|
|
|
|
Th 231 |
|
|
|
|
|
U 240 |
|
|
Nesta tabela, publicada em 1869 na revista alemã Zeitschrift für Chemie, podemos observar a existência de algumas lacunas, referentes a elementos desconhecidos, mas cuja existência foi prevista por Mendeleyev. O ponto de interrogação indica a incerteza em relação ao valor da massa atômica.
Podemos observar que Mendeleyev deixou algumas lacunas na tabela que deveriam ser preenchidas à medida que os elementos fossem descobertos. De fato, a História provou que ele estava certo, pois, em 1875 foi descoberto o elemento gálio (68), em 1879, o escândio (44) e em 1886, o germânio (72).
O trabalho realizado por Mendeleev foi tão profundo e minucioso que acabou sendo utilizado como base da tabela periódica moderna, chegando a prever a existência de elementos ainda não conhecidos na época, como o gálio (chamado por ele de Eka-alumínio) e o germânio (Eka-silício), prevendo suas propriedades com grande precisão.
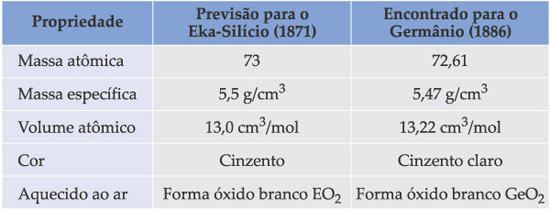
Para estimar a massa atômica do germânio, ele tomou a média das massas do Si (massa atômica = 28) e Sn (massa atômica = 118).
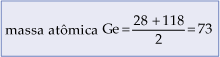
Comparando a tabela formulada por Mendeleev e a tabela periódica atual, encontramos três situações nas quais os elementos se encontram fora da seqüência crescente em relação à massa atômica:
O argônio (39,948) antecede o potássio (39,098); o cobalto (58,933) antecede o níquel (58,693); e o telúrio (127,60) antecede o iodo (126,90).
Estas anomalias foram resolvidas, em 1914, por um inglês, H. G. J. Moseley, que, a partir do estudo dos espectros de emissão de vários elementos, determinou o número de prótons de cada elemento químico.
Com a determinação do número de prótons (número atômico Z) de cada elemento, ele pôde comprovar que as propriedades periódicas eram em função do número atômico crescente e não da massa atômica, como tinha sido estabelecido por Mendeleev.
Lei Periódica é estabelecida nestes termos
“As propriedades dos elementos químicos são uma função periódica do número atômico"
Isso significa que, quando os elementos são ordenados em ordem crescente de números atômicos, observa-se uma repetição periódica de suas propriedades.
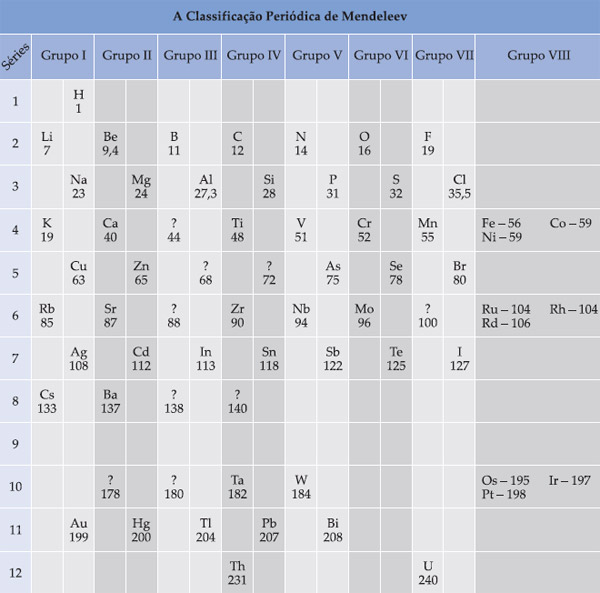
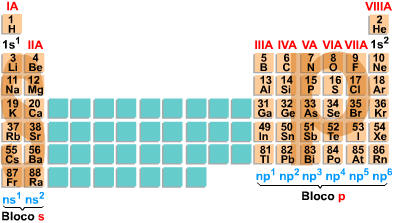
2. Tabela Periódica Moderna
Os elementos encontram-se dispostos em ordem crescente de número atômico e suas posições são estabelecidas através de suas distribuições eletrônicas.
A tabela periódica atual é formada por:
a) sete linhas horizontais, chamadas de períodos. Cada período, exceto o primeiro, começa com um metal alcalino e termina, exceto o último, que ainda se encontra-se incompleto, com um gás nobre.
A estrutura da tabela periódica fica assim, representada:
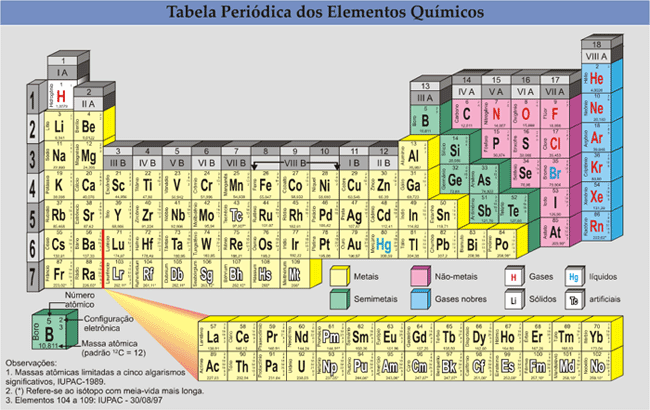
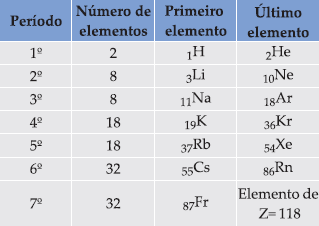

b) As 18 colunas verticais são denominadas de grupos ou famílias. Os elementos que pertencem a uma mesma família apresentam propriedades semelhantes.
As famílias são designadas pelas letras A e B e denominadas de subgrupo; o grupo é indicado por algarismo romano de I a VIII. Por exemplo, o Sc pertence ao grupo III, subgrupo B, ou simplesmente IIIB, enquanto o Boro pertence ao grupo III, subgrupo A, ou simplesmente IIIA. Recentemente, a American Chemical Society recomendou a substituição dos algarismos romanos por números de 1 a 18, para indicar as famílias da tabela periódica.
Por exemplo: o magnésio pertence a família IIA ou 2; o carbono, à família IVA ou 14.
Algumas famílias recebem denominações especiais:
IA ou 1 = metais alcalinos
IIA ou 2 = metais alcalinoterrosos
VIA ou 16 = calcogênios
VIIA ou 17 = halogênios
VIIIA ou 18 = gases nobres

c) Elementos naturais: são encontrados na natureza.
Elementos artificiais: são produzidos em laboratórios.
Os elementos artificiais são classificados em:
– cisurânicos: apresentam número atômico abaixo do urânio (Z = 92). Apenas dois:
o tecnécio (Z = 43) e o promécio (Z = 61).
– transurânicos: apresentam número atômico acima do urânio (Z = 92). O urânio é o último elemento natural, portanto todos os elementos com número atômico acima do urânio são artificiais.
d) Os elementos, na tabela periódica, também podem ser classificados como:
– metais: correspondem a 80% dos elementos conhecidos. São bons condutores de calor e eletricidade e sua condutividade elétrica diminui com o aumento da temperatura; são dúcteis e maleáveis; sólidos à temperatura ambiente, com exceção do mercúrio que é líquido.
– não-metais (ametais): com poucas exceções, esse elementos não conduzem corrente elétrica ou calor (são isolantes). Encontram-se nos estados físicos sólido, líquido e gasoso, em condições ambientes.
– não-metais (ametais): com poucas exceções, esse elementos não conduzem corrente elétrica ou calor (são isolantes). Encontram-se nos estados físicos sólido, líquido e gasoso, em condições ambientes.

Resumindo temos:
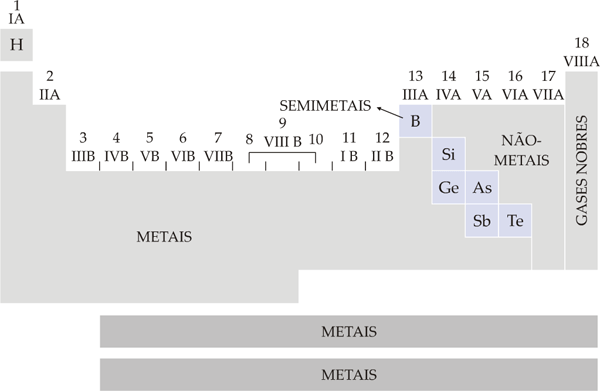
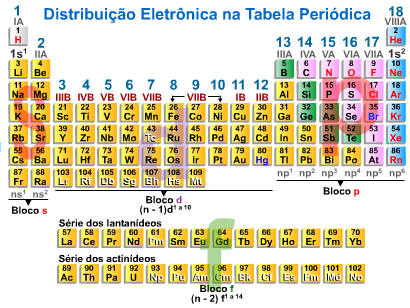
3. Distribuição Eletrônica na Tabela Periódica
3.1. Períodos
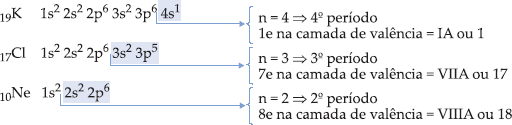
Os elementos que pertencem ao mesmo período apresentam o mesmo número de camadas eletrônicas. Portanto, todos os elementos de um dado período têm em comum a camada de valência, e o número quântico principal desta camada é igual ao número do período.
Assim:
– elementos do 1º período possuem 1 nível de energia ocupado por elétrons.
– elementos do 2º período possuem 2 níveis de energia ocupados por elétrons.
![]()
– elementos do 7º período possuem 7 níveis de energia ocupados por elétrons.
Exemplo
![]()
O Na se encontra no 3º período, pois possui 3 níveis ocupados por e–, e número quântico principal, n = 3, para a camada de valência.
3.2. Famílias
Os elementos pertencentes a uma mesma família apresentam propriedades químicas semelhantes, pelo fato de possuírem o mesmo número de elétrons na camada de valência.
Exemplos
Para a família A, o número da família, em algarismo romano, indica o número de elétrons na camada de valência.
Por exemplo: IA = 1e– na camada de valência
IIA = 2 e– na camada de valência.
A exceção fica com 2He = 1s2, que pertence à família VIIIA.
Também pode ser utilizada a numeração das famílias 1, 2 e de 13 a 18, onde a encontramos:
Família 1 = 1 e– na camada de valência
Família 2 = 2 e– na camada de valência
A partir da família 13, subtrair 10 do número do grupo para encontrar o número de elétrons de valência. Por exemplo:
Família 13 = 13 – 10 = 3 e– na camada de valência.
3.3. Distribuição Eletrônica
ÁTOMOS NEUTROS
Os elementos de uma mesma família apresentam diferentes graus de semelhança em suas propriedades químicas. Na família A, a variação de tais propriedades é mais regular, o que confere a esses elementos o nome de representativos. Neles, o elétron mais energético encontra-se num subnível s (IA e IIA) ou p (IIIA a VIIIA).
Obs. – O Hélio possui número atômico z = 2, portanto encontramos:
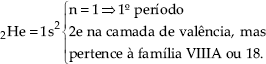
– O elétron de maior energia encontra-se na camada de valência, para os elementos representativos. Portanto, podemos fazer a seguinte relação:
Resumindo temos:

ÍONS
A distribuição eletrônica de íons é semelhante à dos átomos neutros. Lembrando que um íon é formado a partir da perda ou ganho de elétrons que ocorre com um átomo e que os elétrons serão retirados ou recebidos sempre da última camada eletrônica (mais externa), chamada camada de valência, e não do subnível mais energético, teremos, por exemplo, as seguintes distribuições:
11Na: 1s2 2s2 2p6 3s1
 perde 1e da
camada de valência
perde 1e da
camada de valência
11Na+: 1s2 2s2 2p6
26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
 perde 2e da camada de valência
perde 2e da camada de valência
26Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6
Para a distribuição do íon Fe3+, é necessária a retirada de um elétron do subnível d.
26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5
17Cl: 1s2 2s2 2p6 3s2 3p5
 ganha 1e na camada de valência
ganha 1e na camada de valência
17Cl–: 1s2 2s2 2p6 3s2 3p6
Resumindo temos:
Na distribuição eletrônica de íons, a retirada ou o recebimento de elétrons ocorrem na camada de valência e não no subnível de maior energia.
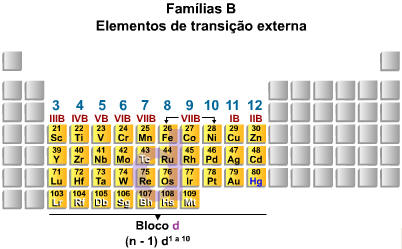
3.4. Elementos de Transição
Os elementos de transição, no centro da tabela periódica (IIIB até IIB, ou 3 a 12) possuem como subnível de maior energia o subnível d, que se encontra na penúltima camada. Portanto, os metais de transição preenchem subníveis nos quais o número quântico principal é uma unidade menor que o número do período. Afora algumas exceções, podemos considerar que os elementos de transição apresentam 2 elétrons na camada de valência e podem ser representados da seguinte maneira:
![]()
Exemplificando, podemos dizer que o 21Sc encontra-se no 4º período, cuja camada de valência é 4s2, e possui subnível de maior energia, 3d.
Para localizarmos o número da família, utilizando a distribuição eletrônica, basta somar o número de elétrons que se encontram no subnível de maior energia com o número de elétrons da camada de valência.
Por exemplo:
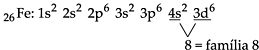
Obs. – Alguns metais de transição, não seguem a distribuição eletrônica de Linus Pauling, dentre os quais destacamos:
Família 6 ou VIB
Crômio e Molibidênio
![]()
Família 11 ou IB
Cobre, Prata e Ouro
![]()
Resumindo temos:
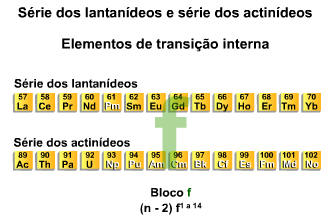
3.5. Elementos de Transição Interna
São os elementos pertencentes à série dos lantanídeos (6º período) e actnídeos (7º período) e que apresentam subnível mais energético o subnível f. São considerados pertencentes à família IIIB ou 3 e estão indicados em linhas fora e abaixo da tabela periódica.
O subnível f, de maior energia, encontra-se na antepenúltima camada e apresenta 2 elétrons na camada de valência. A representação do preenchimento eletrônico para os elementos de transição interna fica.
![]()
![]()
Exemplo

Resumindo temos:
Concluindo ficamos com:
4. Propriedades
4.1. Propriedades Aperiódicas
São propriedades que têm seus valores só aumentando ou só diminuindo quando colocadas em função do número atômico crescente.
São poucas as propriedades aperiódicas e, dentre elas, temos, por exemplo:
– a massa atômica, que aumenta com o aumento do número atômico.
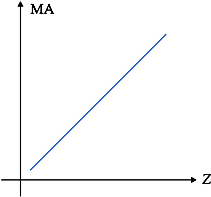
4.2. Propriedades Periódicas
São aquelas que apresentam variação periódica na tabela, crescendo e decrescendo, à medida que o Z aumenta.
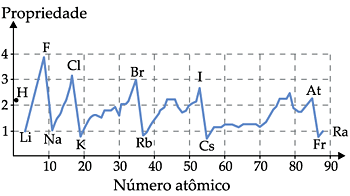
I. Raio Atômico
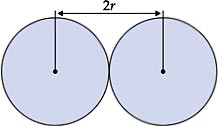
É muito difícil medir o raio de um átomo isolado, pois a eletrosfera não apresenta um limite bem definido. Mas, quando átomos de um elemento empacotam-se em sólidos, são encontradas distâncias definidas de um núcleo ao outro. Portanto, vamos considerar o raio atômico como sendo a metade da distância entre os núcleos de dois átomos vizinhos.
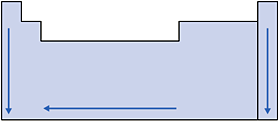
Nas famílias (coluna vertical) os raios atômicos aumentam de cima para baixo, pois, nesse sentido, aumenta o número de níveis de energia dos átomos.
Por exemplo: um átomo do 1o período tem apenas um nível de energia, portanto terá menor raio atômico que um átomo do 2o período (da mesma família) que tem dois níveis de energia.
Nos períodos (linha horizontal), conforme caminhamos para a direita, aumenta o número atômico (número de prótons) para átomos de mesmo número de níveis de energia, portanto aumenta a atração do núcleo pela eletrosfera, diminuindo o tamanho do átomo e conseqüentemente o raio.
Assim, o raio atômico cresce da direita para a esquerda nos períodos.
Esquema:
II. Raios Iônicos
Raio de Cátion
Quando um átomo perde elétron, a repulsão da nuvem eletrônica diminui, diminuindo o seu tamanho. Inclusive pode ocorrer perda do último nível de energia e quanto menor a quantidade de níveis, menor o raio.
Portanto: raio do átomo > raio do cátion
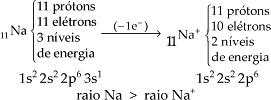
Raio do Ânion
Quando um átomo ganha elétron, aumenta a repulsão da nuvem eletrônica, aumentando o seu tamanho.
Portanto: raio do átomo < raio do ânion
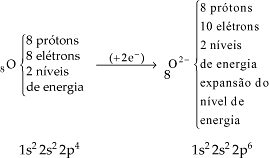
Íons Isoelétricos
Íons isoelétricos são os que apresentam igual número de elétrons e, portanto, o número de níveis é o mesmo. Assim, quanto maior for o número atômico, maior será a atração do núcleo pela eletrosfera e menor o raio.
Exemplo
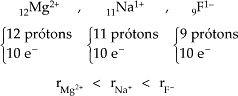
III. Energia (ou Potencial) de Ionização
É a energia necessária para retirar um elétron de um átomo (ou íon) isolado no estado gasoso.
X(g) +
energia
![]() X+(g) + e–
X+(g) + e–
Quando retiramos um elétron de um átomo eletricamente neutro (1a energia de ionização) gasta-se uma certa quantidade de energia, a qual, geralmente, é expressa em elétrons-volt (eV). Se formos retirar um segundo elétron (2a energia de ionização), gasta-se uma quantidade maior de energia, pois, à medida que cada e- é retirado, o raio atômico diminui.
Exemplo
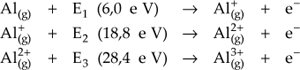
Nas famílias e nos períodos, a energia de ionização aumenta conforme diminui o raio atômico, pois, quanto menor o tamanho do átomo, maior a atração do núcleo pela eletrosfera e, portanto, mais difícil retirar o elétron.
Esquema:
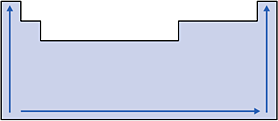
IV. Afinidade Eletrônica ou Eletroafinidade
É a quantidade de energia liberada quando um átomo neutro, isolado no estado gasoso, recebe um elétron.
X(g) + e-
![]() X -(g) + energia
X -(g) + energia
A eletroafinidade pode ser entendida como a medida da intensidade com que o átomo captura o elétron.
Nas famílias e nos períodos, a eletroafinidade aumenta com a diminuição do raio atômico, pois, quanto menor o raio, maior a atração exercida pelo núcleo.
Esquema:
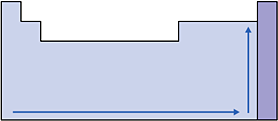
V. Eletronegatividade
É a capacidade que um átomo possui de atrair para si o par de elétrons, compartilhado com outro átomo.
Nas famílias e nos períodos, a eletronegatividade cresce conforme o elemento apresenta o menor raio atômico, com exceção dos gases nobres, pois a atração do núcleo pela camada de valência será maior.
Esquema:
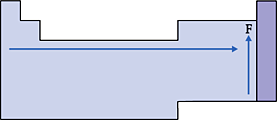
VI. Volume Atômico
É o volume ocupado por 1 mol de átomos (6,0 · 1023 átomos) do elemento no estado sólido.
Assim, o volume atômico depende, além do volume dos átomos, do espaçamento que ocorre entre eles.
Nas famílias, o volume atômico aumenta de acordo com o aumento do raio.
Nos períodos, o volume atômico aumenta de acordo com o aumento do raio, mais ou menos do centro da tabela para a esquerda; já do lado direito, a variação é oposta, isto é, devido ao maior espaçamento que ocorre entre os átomos, principalmente nos metais.
Esquema:
VII. Densidade Absoluta
Densidade (d) de um elemento é a razão entre sua massa (m) e seu volume (V).
![]()
Nas famílias, a densidade aumenta de cima para baixo, pois, nesse sentido, a massa cresce mais que o volume.
Nos períodos, a densidade aumenta das extremidades para o centro, pois, quanto menor o volume, maior a densidade, já que a variação de massa nos períodos é muito pequena.
Esquema:
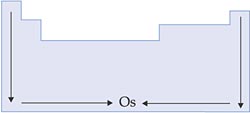
VIII. Pontos de Fusão e de Ebulição
Os pontos de fusão e ebulição são, respectivamente, as temperaturas nas quais o elemento passa do estado sólido para o líquido e do estado líquido para o gasoso.
Nas famílias, os pontos de fusão e de ebulição aumentam de acordo com a densidade, pois, quanto mais denso e compacto o retículo cristalino, mais difícil a separação dos átomos.
Nas famílias dos metais alcalinos e dos alcalinoterrosos, o crescimento é oposto ao das demais.
Nos períodos, os pontos de fusão e de ebulição aumentam também com o aumento da densidade.
Esquema:
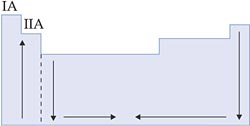
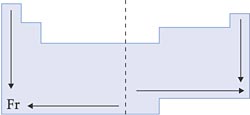
IX. Eletropositividade ou Caráter Metálico
É a capacidade que um átomo possui de doar elétrons.
Nas famílias e nos períodos, a eletropositividade aumenta conforme aumenta o raio atômico, pois, quanto maior o raio, menor a atração do núcleo pela eletrosfera, mais fácil de doar elétrons.
Esquema:
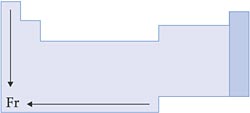
X. Reatividade Química
Um elemento é considerado muito reativo, quando perde ou ganha elétrons com facilidade. Portanto, para os metais, a reatividade aumenta à medida que diminui o potencial de ionização; para os ametais, a reatividade aumenta à medida que aumenta o potencial de ionização.
Esquema:
Este site foi atualizado em 04/03/19